
Можно ли сделать вакцину, которая справится со всеми коронавирусами сразу и которую не нужно будет обновлять каждые полгода? Теоретически — да, и ученые уже работают над этим
Мы рассказываем честно не только про войну. Скачайте приложение.
Недавно в Великобритании была зарегистрирована первая вакцина, направленная против доминирующего сейчас в мире варианта омикрон. Это, безусловно, большой, пусть и несколько запоздалый, шаг вперед. Однако, кажется, почти никто не надеется на то, что пандемия с появлением этой вакцины закончится. И это поднимает более фундаментальный вопрос — можно ли в будущем создать такую вакцину, которую в принципе не надо было бы постоянно обновлять? Вакцину, которая защищала бы от всех вариантов вируса сразу? Теоретически это возможно. Фундамент для создания таких («панкоронавирусных») вакцин ученые заложили еще до начала нынешней эпидемии, в том числе и в знаменитом Уханьском институте вирусологии. Почему же тогда их до сих пор не существует? На основе чего они могут быть сделаны и в чем заключаются главные трудности ее разработки? «Медуза» пытается разобраться в этих вопросах.
Что такое панкоронавирусная вакцина, в чем ее идея, чем она лучше обычной?
Первая в мире вакцинация против ковида вне рамок клинических исследований состоялась в декабре 2020 года в Великобритании. Менее года прошло между стартом массовой вакцинации и ноябрем 2021-го, когда в той же Великобритании начал широко распространяться омикрон — вариант вируса, против которого эта вакцина оказалась уже малоэффективной. Аналогичная ситуация постепенно сложилась и в других странах: хотя вакцины по-прежнему защищают от тяжелого развития болезни, сейчас они очевидно устарели.
В связи с этим в июле этого года FDA утвердило новые варианты противоковидных вакцин, которые несут дополнения в своем антигенном репертуаре. Это большой шаг вперед, но развитие пандемии не позволяет надеяться на то, что нынешние линии BA.4, BA.5 или вообще весь омикрон станут последними из вариантов SARS-CoV-2. В идеале хотелось бы не обновлять вакцину каждые полгода, а создать препарат, который бы защищал от всех штаммов коронавируса, даже от тех, что еще только могут появиться.
Поэтому глобальная задача — это разработка так называемой панвакцины, которая будет создавать защиту от широкого спектра коронавирусов, одновременно от всех существующих и будущих штаммов и линий. В минимальном варианте такой препарат будет помогать бороться с SARS-CoV-2 независимо от его разновидности. В максимальном — ученые надеются создать вакцину, которая будет защищать организм даже от разных видов всего семейства коронавирусных (Coronaviridae). В него входят, помимо SARS-CoV-2:
- SARS-CoV-1 — возбудитель «атипичной пневмонии» 2008 года;
- вирус MERS — причина ближневосточного респираторного синдрома;
- сезонные коронавирусы, вызывающие ОРВИ (на данный момент у человека их известно четыре вида);
- другие коронавирусы, хозяевами которых являются животные.
Главный исследователь ВОЗ Соумиа Сваминатан в апреле заявил, что подобные вакцины появятся в течение двух лет. К тому времени около десяти платформ уже начали исследования в этой области, в основном оставаясь на доклиническом этапе. Рассматривались препараты как для инъекций, так и для перорального введения.
Что конкретно мешает сделать панвакцину?
Вирусы обладают большим генетическим разнообразием, а многие, такие как коронавирус, еще и быстро эволюционируют. Их геном, а значит и облик для иммунной системы, меняются. Чтобы вакцинный препарат работал для нескольких штаммов и тем более видов вируса одновременно, нужно:
- либо включать в него сразу много компонентов, которые будут «ключами ко всему»;
- либо находить среди вирусной группы какие-то универсальные или хотя бы просто похожие элементы, что часто довольно затруднительно.
Подход с использованием «ключей ко всему» тоже не всегда хорош, ведь вакцинный препарат не может быть бесконечно огромным. Кроме того, всегда есть риск того, что сконструированный в лаборатории препарат может оказаться совершенно бесполезным — потому что он не вызывает иммунного ответа, хотя и должен это делать.
Вообще же трудности, которые возникают при разработке вакцин широкого профиля, можно разделить на две большие группы:
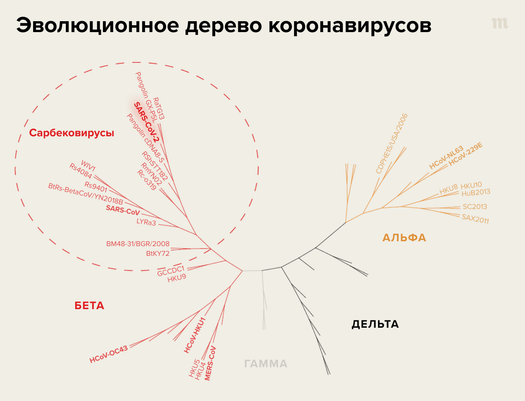
- Во-первых, создание такой вакцины требует глубокого понимания общего эволюционного ландшафта вирусов той группы, против которой требуется сделать новый препарат. Это понятное, но трудновыполнимое на практике требование. Существующие оценки говорят о том, что на сегодняшний день мы знаем только крайне малую часть разнообразия вирусов. Так, считается, что только для вирусов млекопитающих и птиц более полутора миллионов разновидностей еще не описано. В целом же хоть сколько-то детально изучено на сегодняшний день не более двадцати тысяч вирусов. При этом понятно, что если вы знаете лишь малую долю от всего мирового разнообразия коронавирусов, то ваша будущая вакцина — даже если не будет никаких технических трудностей в ее разработке и производстве — с большой вероятностью будет неэффективна против тех вирусов, которых вы еще не знаете. Именно поэтому для создания такой вакцины необходимо и изучение еще не открытых видов (в том числе та работа, которой занимались ученые в Уханьском институте вирусологии), и максимально аккуратное предсказание того, какими они могут быть, на основе разнообразных моделей эволюции.
- Во-вторых, возникает проблема комбинирования особенностей разных вирусов в одной вакцине. К сожалению, здесь недостаточно просто найти некие общие (консервативные) маркеры в геномах всех вирусов группы, собрать их в одном «коллективном портрете» вирусной группы и надеяться на хорошую эффективность полученной вакцины. Нужно еще, чтобы эти маркеры могли хорошо активировать иммунную систему (были иммуногенными). До сих пор биологи не всегда понимают, почему одни антигены хорошо проявляют иммуногенность, а другие нет, — в итоге поиск нужных маркеров-антигенов выливается в метод проб и ошибок.
Эти теоретические сложности легко проиллюстрировать на примере конкретного SARS-CoV-2. Так, известно, что к мембранному коронавирусному белку M антитела в человеческом организме практически не образуются. При этом его строение вроде бы вполне к тому располагает: он находится на поверхности вирусной частицы и некоторые его участки должны контактировать с антителами. Обычно это и есть первая «зацепка» для предсказания правильного антигена: расположение на внешней поверхности и подходящая структура какой-нибудь части белка (удачным образом торчащая петля и подобные особенности).
Но есть и обратный пример: у большинства переболевших ковидом людей вырабатываются антитела к N-белку, который расположен вообще внутри вирусной частицы. Антитела к нему появляются, видимо, потому, что в какой-то момент вирусная частица по той или иной причине может открываться и вступать в контакт с клетками иммунной системы. Например, когда вирус попал в межклеточное пространство не созревшим или, наоборот, когда вирусная частица уже деградировала и распалась. В плане предсказания иммуногенности оба примера означают одно — что теоретически предсказанные кандидаты в «хорошие антигены» в итоге могут оказаться провальными, а хорошо работать могут какие-то другие.
Яркий пример того, как слабость существующих предсказательных подходов отражается на разработке вакцин, — история «ЭпиВакКороны». Ее создатели с самого начала заявляли, что специально проводили подбор пептидов (участков белка) для включения в вакцину таким образом, чтобы найти самые консервативные и устойчивые к будущим изменениям вируса участки. В результате оказалось, что полученные таким образом пептиды вообще не дают нужного иммунного ответа и вакцина оказывается совершенно неэффективной.
И как тогда пытаются сделать панкоронавирусные вакцины? На основе чего?
Производители в итоге идут разными путями, но в любом случае создание панкоронавирусных вакцин сейчас находится на относительно ранней стадии. Поэтому, как и в случае обычных противоковидных вакцин в середине 2020 года, здесь есть большое разнообразие многообещающих кандидатов. Среди «обычных» вакцин к регистрации пришли препараты только трех типов: инактивированные (российский «КовиВак», препараты Sinovac, Sinopharm и т. д.), аденовирусные («Спутник V», AstraZeneca, J&J) и мРНК-вакцины (BioNTech-Pfizer, Moderna). При этом панвакцины не могут быть инактивированными, но здесь разнообразие типов все равно побольше:
- Уже известные мРНК-вакцины, они содержат генетический материал вируса в форме рибонуклеиновой кислоты, заключенной в специальную липидную оболочку. Разработкой панвакцин такого типа занимаются, например, компании BioNTech — Pfizer, Moderna и Gritstone Bio.
- Аденовирусные панвакцины. Носителем генетического материала — «вектором» — служит в них человеческий аденовирус одного из нескольких типов. Такие вакцины разрабатывают, например, в компании ImmunityBio и в Институте человеческих вакцин Дюка.
- Белковые и пептидные вакцины содержат непосредственно вирусные белки или их участки, соединенные с какими-нибудь носителями. В качестве носителя может выступать, например, шарообразная молекула ферритина («обычных» противоковидных вакцин такого типа пока не зарегистрировано). Такие препараты разрабатывают, например, в Армейском научно-исследовательском институте имени Уолтера Рида в США.
- ДНК-вакцины — довольно редкий тип вакцин, где необходимый генетический материал вируса закодирован на небольшой кольцевой молекуле ДНК — плазмиде. Панвакцину такого рода разрабатывают сейчас в британской компании DioSynvax.
Более подробно о разных типах первых вакцин против SARS-CoV-2 «Медуза» писала в начале пандемии.
Разработка каких вакцин ближе всего к финалу?
Сейчас уже около двадцати проектов продемонстрировали первые результаты. В основном они получены только на лабораторных животных, но в отдельных случаях и на людях. Вот некоторые из тех, что продвинулись дальше остальных:
- мРНК-вакцина BioNTech-Pfizer. Производители обещают, что во второй половине 2022 года приступят к ее клиническим испытаниям, результаты исследований на животных пока не опубликованы. Утверждается, что вакцина дополнительно стимулирует развитие Т-клеточного ответа иммунитета. Это особенно интересно потому, что обычно, когда говорят об иммунитете против коронавируса, упоминают только антитела, хотя уже известно, что там задействованы самые разные механизмы. У людей, переболевших коронавирусом, может и не наблюдаться антител, но по Т-клеточному анализу иногда можно выявить наличие к нему иммунитета. Он служит важным звеном в защите от болезни.
- Панвакцина Mosaic-8b Калифорнийского технологического института основана на так называемой технологии мозаичных наночастиц, разработанной в Оксфорде. В ее состав входят фрагменты шиповидного белка (спайка) из восьми разных бета-коронавирусов (отсюда и название), создатели рассчитывают, что она будет формировать иммунитет против всех коронавирусов этой группы. Исследования на мышах и макаках уже показали, что вакцина предоставляет защиту даже от тех коронавирусов, фрагменты которых не были частью структуры наночастицы. Клинические испытания препарата пока не начались.
- ДНК-вакцина DIOS-CoVax делается в рамках отделившегося от Кембриджского университета проекта DioSynvax. Проект недавно получил премию Coalition Epidemic Preparedness Innovations (CEPI) в 42 миллиона долларов именно для разработки коронавирусной панвакцины. Препарат отличается не только типом носителя генетической информации, но и методом инъекции — ее вводят с помощью специального пружинного механизма (посмотреть, как он работает, можно здесь). Клинические испытания первой фазы уже начались, в них участвуют 36 человек, результаты пока неизвестны. Предварительные испытания на мышах показали нейтрализацию сывороткой иммунизированных животных разных видов коронавирусов (SARS-CoV-1, WIV16, RATG13), а также разных штаммов внутри SARS-CoV-2.
- Панвакцина RBD-scNP разрабатывается в Институте человеческих вакцин Дюка (DHVI). Это белковая (субъединичная) вакцина, которая содержит фрагмент шиповидного белка, связанного с белком ферритином. Клинические испытания планируется начать только в следующем году. Предварительные результаты были продемонстрированы (1, 2) на макаках: сыворотка крови после вакцинации нейтрализовала восемь разных вариантов SARS-CoV-2, а также SARS-CoV-1 и два коронавируса летучих мышей.
- Американская компания Gritstone Bio разрабатывает мРНК -панвакцину под рабочим названием GRT-R910. Она, в отличие от хорошо известных мРНК-вакцин, обладает свойством саморепликации — то есть может какое-то время копироваться в организме, что удлиняет ее время жизни и, по идее, должно способствовать более выраженному иммунному ответу. Вакцина представлена в двух вариантах, можно даже сказать, что речь о двух разных вакцинах с одной мРНК-начинкой: в липидной оболочке или внутри аденовирусного вектора. Лабораторные результаты по нейтрализации SARS-CoV-1 и SARS-CoV-2 уже показаны на мышах и макаках, сейчас проводятся два клинических исследования первой фазы, в них участвуют около полутора сотен человек в Великобритании и США.
- ImmunityBio разрабатывает панвакцину на базе аденовирусного вектора Ad5 (такой же используется во втором компоненте «Спутника V»). Вакцина содержит два фрагмента генома коронавируса — известный шиповидный белок дополнен (менее известным) нуклеокапсидным. Исследователи полагают, что наличие последнего приведет к возникновению дополнительного Т-клеточного ответа при формировании иммунитета. Кроме препарата для инъекций ImmunityBio делает также варианты для перорального и интраназального введения. Предварительные результаты на мышах и макаках показали устойчивость сыворотки иммунизированных животных к разным штаммам SARS-CoV-2. Сейчас идут сразу несколько клинических испытаний первой фазы для разных вариантов препарата, одна из них уже завершена.
- MigVax создает панвакцину для перорального введения. Она базируется на разработках вакцины против вируса инфекционного бронхита птиц. Пока результаты по исследованию на мышах и крысах были показаны только для одного штамма SARS-CoV-2, но ввиду широты профиля исходной вакцины исследователи полагают, что она будет защищать от обширного спектра представителей семейства коронавируса, и скоро приступают к первой фазе клинических испытаний.
- Панвакцина SpFN разрабатывается армией США (точнее, Армейским научно-исследовательским институтом имени Уолтера Рида). Как и RBD-scNP, это белковая вакцина на основе ферритина, однако в данном случае она дополнена адъювантом собственной разработки (он же используется в коронавирусных вакцинах Shringrix и Novavax). Это один из самых первых кандидатов в панвакцины, сейчас опубликовано уже пять научных статей по результатам исследований на животных, и в ближайшее время ожидается публикация результатов по первой фазе исследований на людях. Пока известно, что вакцина продемонстрировала защиту против нескольких штаммов коронавируса на мышах, хомяках и двух видах макак.
Даже таким (возможно, избыточным) списком все кандидаты в панвакцины, конечно, не исчерпываются. Нужно понимать, что провести четкую границу между панвакцинами и вакцинами, которые просто содержат больше одного антигена, пока довольно затруднительно. При большом желании панвакцинами можно объявить и, например, новые бивалентные вакцины, которые разрабатывают Pfizer и Moderna.
Но не только их: существует, например, компания Vaxart, которая разрабатывает вакцину для интраназального введения (по мнению многих исследователей, именно такая форма должна стать доминирующей, если мы хотим, чтобы вакцины защищали не только от тяжелого заболевания, но и от инфекции и передачи заболевания). Вакцина Vaxart, хотя и не задумывалась как панкоронавирусная, тем не менее показала результаты по нейтрализации у приматов разных штаммов SARS-CoV-2, включая бету, дельту, альфу и омикрон.
Когда панкоронавирусная вакцина может появиться в ближайшей поликлинике? Почему все происходит так медленно?
Пока невозможно предсказать, когда будет (и будет ли) зарегистрирована и произведена первая вакцина, защищающая от всех коронавирусов. Сроки завершения клинических исследований первой фазы у всех рассмотренных выше компаний очень часто сдвигаются, но если пытаться сопоставить их предыдущие успехи с нынешними планами, то речь, по-видимому, идет о завершении испытаний в пределах полугода-года. Затем должны последовать еще вторая и третья фазы клинических исследований — они тоже займут значительное время. И нет гарантий, что увенчаются успехом. Даже такие известные компании, как Pfizer и Moderna, пока идут по этому пути далеко не в числе первых.
Разработка панкоронавирусной вакцины сейчас сталкивается не только с технологическими сложностями. Во-первых, американская программа ускоренного финансирования создания вакцин против ковида WARP Speed, благодаря которой производство было оплачено и началось еще до завершения испытаний, на панвакцины не распространяется. Значительной финансовой инициативы для того, чтобы заниматься этой работой, у производителей нет.
Кроме того, уже сейчас разработчики в США сталкиваются с дефицитом как производственных мощностей (особенно для мРНК-вакцин), так и лабораторных животных, которые нужны для исследования вакцин. Многие из них в разговоре с журналистами Science также жалуются на то, что в обществе исчезло чувство опасности, которое подстегивало инициативы по ускоренной разработке противоковидных вакцин, — сейчас угроза новой пандемии как будто ушла на второй план.
Анна Казнадзей
(1) Насколько устарели?
Существенно. Например, эффективность защиты при полной вакцинации Pfizer без бустера падает примерно с 90 до 60% за полгода против дельты, но для омикрона соответствующие значения еще более слабые: падение происходит с 60% до менее чем 20%. Бустер повышает эффективность, но тоже временно. Эффективность вакцин против актуальных вариантов вируса можно уточнить в серии отчетов Агентства по безопасности здравоохранения Великобритании.
(2) Доклиническая фаза исследований
То есть лабораторные исследования на животных, которые проводятся до применения в клинической практике.
(3) Матричная РНК, мРНК
Это РНК, в которой закодирована последовательность белка.(4) Почему не инактивированные?
Инактивированные вакцины делаются из настоящих вирусов, их сложно сделать из коллективного портрета группы разных вирусов.
(5) Бивалентные вакцины
То есть вакцины, имеющие два разных антигена. Также встречаются трех- и многовалетные препараты.
(6) Фазы клинических исследований
Клинические исследования проводятся обычно в три этапа, которые отличаются задачами исследования и размером группы добровольцев. Для вакцин обычно первая и вторая фаза проводятся на нескольких десятках человек, задача исследования — подтвердить безопасность и иммуногенность препарата. Третья фаза проводится на многих тысячах добровольцев, в ней определяется защитная эффективность препаратов.