Абсолютно исчерпывающий (и постоянно обновляемый) путеводитель «Медузы» по вакцинам от коронавируса
Мы рассказываем честно не только про войну. Скачайте приложение.
О том, какие вакцины от вируса SARS-CoV-2 разрабатываются в мире, чем они отличаются технологически и какие у разных технологий ограничения, мы подробно писали еще в начале мая. Сейчас в России уже идет вакцинация, зарегистрирована не одна, а три (очень разные) вакцины, а новости об исследованиях и производстве приходят почти каждый день. Здесь мы продолжаем собирать важные данные о вакцинах с точки зрения их реальной применимости.
Этот материал был значительно обновлен 25 февраля после долгого перерыва. Добавлена новая информация по всем российским вакцинам.
Последние обновления
25 февраля — обновлена информация по всем российским вакцинам и вакцинам, клинические испытания которых проводятся в России
2 февраля — обновлены и фактически переписаны вводная часть и главы про российские вакцины
9 декабря — добавлена информация по первым результатам испытания инактивированных вакцин, а именно китайской Sinovac Biotech
4 декабря — добавлена информация по текущим планам производства вакцины «Спутник V»
3 декабря — обновлены данные по вакцине Moderna и Pfizer/BioNTech
24 ноября, 14:00 — добавлены результаты второго промежуточного анализа эффективности по вакцине «Спутник V»
Какие вакцины получат россияне
Согласно последнему обзору ВОЗ (23 февраля 2021 года), в мире проходят клинические исследования 73 вакцин, еще 182 препарата исследуются на животных. До важнейшей третьей фазы испытаний, по результатам которой становится понятно, снижает ли вакцина вероятность заболеть, пока добралась 21 вакцина. К сожалению, некоторые производители уже сообщили о прекращении дальнейших разработок четырех вакцин в связи с неудовлетворительными результатами.
Полностью исследования ни по одной из вакцин не завершились, поэтому постоянной регистрации ни одна не получила. Однако несколько препаратов уже получили временную или экстренную регистрацию. Это вакцины следующих производителей:
- Pfizer/BioNTech
- Moderna
- Центр им. Гамалеи
- Центр «Вектор»
- AstraZeneca
- CanSino Biologics
- Sinopharm
- Sinovac
- Bharat Biotech
- Центр им. Чумакова РАН
При этом важно подчеркнуть, что сам факт регистрации в той или иной стране ничего не говорит о степени исследованности вакцины: если некоторые разработчики (Pfizer/BioNTech, Moderna, частично AstraZeneca) выложили полные доклады о результатах исследования эффективности, опубликовали статьи в научных журналах и получили регистрацию в ходе публичной экспертизы и открытого обсуждения, то относительно других вакцин таких подробностей нет либо они ограничены короткими пресс-релизами. Подробнее об этих особенностях будет сказано ниже.
Не все зарегистрированные или испытываемые сейчас в мире вакцины станут доступны в России — по сочетанию регуляторных и экономических причин. Во-первых, для регистрации нового препарата необходимо пройти экспертизу Минздрава; то есть перед регистрацией потребуется проведение отдельных клинических исследований в России либо включение российских медучреждений в международные исследования. Из иностранных компаний только китайская CanSino Biologics и англо-шведская AstraZeneсa начали такие исследования. Во-вторых, уже сейчас, когда в России зарегистрированы два российских препарата («Спутник V» и «ЭпиВакКорона»), ни один иностранный производитель не сможет претендовать на государственные закупки вакцин по правилу «третий лишний» — а значит, серьезных экономических стимулов для начала испытаний вакцины в России у иностранных производителей нет. Возможно, вакцины CanSino Biological или AstraZeneca все-таки будут доступны после регистрации, но, скорее всего, только в частном порядке, вне рамок ОМС. В конце 2020-го о планах привезти вакцину Pfizer/BioNTech в кластер Сколково, где действует особый регуляторный режим, сообщала клиника «Хадасса», однако и она вскоре отказалась от своих планов и начала вакцинацию «Спутником V».
Таким образом, россияне сейчас и в ближайшем будущем могут рассчитывать всего на пять вакцин: «Спутник V» Центра им. Гамалеи, «ЭпиВакКорону» центра «Вектор», «Ковивак» Центра им. Чумакова, «Конвиденцию» китайской компании CanSino Biological и вакцину AstraZeneca. В ближайшее время в большинстве прививочных пунктов можно будет найти фактически только «Спутник V». В планах правительства по производству он составляет львиную долю всех российских вакцин: «Спутника V» планируется произвести 83 миллиона комплектов доз за первое полугодие 2021 года, «ЭпиВакКороны» — 5,4 миллиона комплектов.
Исходя из этого, путеводитель о вакцинах разделен на три группы препаратов: те, которые испытываются в России и имеют хоть какие-то шансы попасть в ближайшую поликлинику; вакцины, которые зарегистрированы или дошли до результатов III фазы испытаний в других странах, и все остальные вакцины.
Клинические испытания, фазы и регистрации — что это?
Для того, чтобы вакциной мог привиться любой желающий, ее, как и всякое лекарственное средство, должны зарегистрировать. Делается это на основании экспертизы Минздрава, на которую подают множество документов, в том числе результаты исследований (процедуру регулирует Федеральный закон «Об обращении лекарственных средств» от 12.04.2010 № 61-ФЗ). Хотя для регистрации не всегда нужны исследования (в законе есть ряд исключений), для новой вакцины они точно необходимы.
Все исследования делятся на доклинические и клинические. Первые проводятся на животных, вне лечебных учреждений, вторые — на людях-добровольцах. В соответствии с мировой практикой (она формализована в стандартах Надлежащей клинической практики GCP, но в разных странах может немного отличаться) клинические исследования делятся на три этапа, или фазы, которые иногда могут быть совмещенными. В ходе фазы I на небольшой (десятки человек) группе здоровых добровольцев проверяют общую безопасность препарата. В ходе фазы II, которая проводится на сотнях добровольцев, обычно подбирают подходящую дозу препарата. В случае вакцины прежде всего смотрят на иммунную реакцию после вакцинации: вырабатываются ли антитела, активируются ли лимфоциты, в какой из групп, получающих вакцину (группы, отличающиеся количеством или вариантом вакцины), это происходит наиболее оптимальным способом. Эти данные позволяют косвенно оценить будущий защитный эффект вакцины, но не предсказывают его со 100%-ной точностью. В фазе III, где участвуют уже тысячи и десятки тысяч добровольцев, эффективность вакцины проверяется «в лоб»: исследователи ждут определенного числа заболеваний и сравнивают число заболевших среди тех, кто получил новый препарат, и тех, кто получил плацебо. Сопоставляя количество заболевших с количеством людей в группах, рассчитывают риск заболевания — соотношение рисков и будет эффективностью вакцины.
Все клинические исследования до начала проведения регистрируются в специальных реестрах: национальном (в России он называется Реестр разрешений на проведение клинических исследований) и международном — clinicaltrials.gov (обязательном для производителей из США и добровольном для всех остальных). В реестрах приводится информация о том, кто проводит исследование, для чего и сколько в нем участвует добровольцев, а также главные ожидаемые показатели — конечные точки (endpoints). Конечные точки исследований разных вакцин могут отличаться (например, одни разработчики смотрят на количество заболевших, другие — на количество инфицированных, третьи — на количество тяжелых больных, и все это разные вещи), но их указывают заранее. В план исследования можно вносить поправки, но это считается очень рискованной практикой. Исследования проводятся по подробному протоколу, который обычно не публикуется, так как считается интеллектуальной собственностью проводящей исследование организации. Впрочем, в случае вакцины COVID-19 многие разработчики сами опубликовали свои протоколы. В России статья 37 закона «Об обращении лекарственных средств» требует публикации результатов экспертизы, на основании которой принимается решение о регистрации лекарственных средств. Цитата:
Соответствующий уполномоченный федеральный орган исполнительной власти размещает на своем официальном сайте в сети «Интернет» информацию, связанную с осуществлением государственной регистрации лекарственных препаратов, в том числе проведением экспертизы лекарственных средств (включая результаты ее проведения), информацию о зарегистрированных лекарственных препаратах и лекарственных препаратах, исключенных из государственного реестра лекарственных средств, не позднее чем через пять рабочих дней со дня получения уполномоченным федеральным органом исполнительной власти соответствующей информации.
Однако до сих пор это требование Минздравом игнорируется.

Что такое «эффективность» и «безопасность»? Нужно ли вакцинироваться лично мне?
Задача этого текста — дать общее представление о ландшафте имеющихся на сегодня вакцин от коронавируса и о том, что с ними происходит. Если же вы стоите перед практическим выбором, делать ли прививку лично вам, — прочитайте другой наш текст, который должен помочь правильно взвесить все за и против. Его же можно рекомендовать тем, кто хочет понять, насколько вакцины безопасны и как эту безопасность измеряют.
Для тех, кто хочет понять, как определяется эффективность вакцин и как можно разные описанные здесь вакцины сравнивать по этому параметру, есть отдельный текст (даже с формулами!).
Вакцины, которые испытываются в России
«Спутник V» («Гам-КОВИД-Вак») Центра им. Гамалеи
- Тип: аденовирусная
- Эффективность: 91,4%, по статье в The Lancet
- Хранение: −18 °С — 6 месяцев, 2–8 °С — 2 месяца (переоформлено)
- Документы: инструкция, карточка препарата в ГРЛС, для высушенной формы — отдельная инструкция
- Статус: зарегистрирована в России и еще 23 странах, список постоянно расширяется
- Особенности: есть несколько форм, в том числе высушенная, и исследуемый «Спутник Лайт», то есть отдельно применяемый первый компонент
Что это?
Вакцина на основе двух типов человеческого аденовируса, который выступает вектором, то есть носителем генетической информации коронавируса SARS-CoV-2. На основе этой информации клетки вакцинированного производят S-белок (он же спайк) — он и вызывает иммунную реакцию, в частности, образование антител и активацию T-клеток.
Чем эта вакцина отличается от других?
Сейчас разрабатывается более десятка похожих аденовирусных вакцин; к отличительным чертам «Спутника V» можно отнести двухэтапную иммунизацию двумя разными аденовирусными типами: сначала в качестве вектора используется более редкий аденовирус-26, затем (через 21 день) делается повторная вакцинация вторым компонентом на основе аденовируса-5. Поскольку компоненты разные, они не взаимозаменяемы.
Теоретически такая схема должна компенсировать проблему, которая касается всех аденовирусных вакцин, — низкую эффективность у тех людей, у которых уже есть антитела к распространенным аденовирусам. Еще одна особенность: «Спутник V» выпускается в двух формах — замороженной и высушенной. Высушенная форма упрощает логистику, но формально является другим препаратом, который требует отдельного исследования и регистрации.
На какие больше всего похожа?
Из дошедших до III фазы испытаний — на вакцину Johnson & Johnson и CanSino Bio. В обеих используются аденовирусы человека (тип 5 и 26), но не в двухкомпонентной схеме, а просто проводятся две вакцинации одинаковыми препаратами.
Результаты испытаний на животных до сих пор не опубликованы, хотя глава группы разработчиков анонсировал соответствующую статью в интервью «Медузе» еще в середине июля.
Результаты испытаний I/II фазы опубликованы в журнале The Lancet. У добровольцев (суммарно 76 человек) вырабатывались антитела, в том числе нейтрализующие. В группах почти не было людей старше 30 лет.
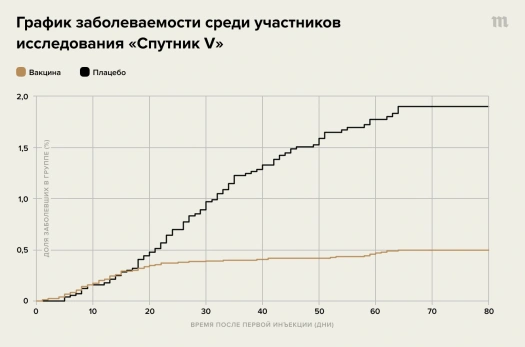
Результаты испытаний III фазы были опубликованы 2 февраля. «Медуза» подробно разбирала главные выводы публикации а также реакцию на статью в научном сообществе. Главные выводы заключаются в том, что вакцина, по-видимому, безопасна и эффективна: эффективность составила 91,6% (95%-й доверительный интервал 85,6–95,2), она примерно одинакова во всех возрастных группах, защитное действие вакцины начинает сказываться примерно на 18–20-й день после первой прививки (хотя мы не знаем, насколько она в этот момент эффективна в абсолютных значениях).
Помимо основных исследований фазы III, сейчас проходят дополнительные испытания «Спутника V»: исследование в группе людей старше 60 лет, исследование отдельного первого компонента, получившего в такой формулировке название «Спутник Лайт», и исследование среди онкопациентов. Во всех из них планируется привлечь всего по 150–250 человек, группы плацебо нет, поэтому эффективность вакцинации в них установить не удастся.
Что с производством?
Последние данные по производству вакцины были озвучены премьер-министром Михаилом Мишустиным 20 февраля на заседании правительственной комиссии:
Накопленным итогом на сегодняшнюю дату произведено 11,1 миллиона комплектов доз вакцин, которые сегодня находятся в обороте. Планируем на сегодняшний день (подчеркну: именно на сегодняшний день), что до конца первого полугодия объем производства составит (пока без «КовиВака») 88 миллионов комплектов доз. Львиная доля — 83 миллиона комплектов доз — приходится на «Спутник V», и 5,4 миллиона комплектов — «ЭпиВакКорона». В I квартале 2021 года планируемый объем производства вакцин мы ожидаем на уровне 30,5 миллиона комплектов доз. Исходя из планов производства в первом полугодии 2021 года, по нашим оценкам, гражданам для вакцинации будет доступно 59 миллионов комплектов доз вакцины. На сегодняшний день выпущено для использования населением 7,9 миллиона комплектов доз вакцин.
(По словам вице-премьера РФ Татьяны Голиковой от 23 января, в России было проведено 7,6 миллиона доз вакцины, из которых 2,1 миллиона доз направлены в регионы страны.)
РФПИ уже заключил несколько экспортных контрактов на поставки миллионов доз за рубеж: 10 миллионов в Бразилию, 2 миллиона в Сербию, 2,6 миллиона в Боливию, 2 миллиона доз в Венгрию и так далее. Ни сроков поставок, зафиксированных в договорах, ни площадок для производства, которые будут поставлять вакцину на экспорт, в РФПИ не раскрыли (возможно, это контракты с поставкой через полгода вакцины из Турции). Однако известно, что доля экспорта от общего производства может быть очень значительной — например, в Аргентину еще до наступления 2021 года было отгружено 300 тысяч двухкомпонентных доз, то есть одна пятая от всего того, что имелось к тому моменту в России.
Кроме отдельных сведений, озвучиваемых чиновниками, статистика по вакцинации в России, в отличие от Израиля, США, Аргентины и многих других стран, не публикуется. Не известно, например, ни реальное количество вакцинированных, ни темпы производства на разных площадках, ни объемы экспорта. По данным издания РБК на 20 февраля, число получивших первую дозу вакцины от COVID-19 суммарно во всех 85 регионах составляет 3,23 миллиона человек — около 2,2% населения России.
В связи с недостатком данных пока невозможно сказать, как на самом деле идет вакцинация и что является ее «бутылочным горлышком»: отсутствие вакцин или нежелание россиян прививаться (вакцинных скептиков в России было много еще до пандемии, относительно «Спутника V» их стало даже больше). В любом случае Россия пока сильно отстает по темпам вакцинирования от таких стран, как Израиль, США, Великобритания, ОАЭ, Бахрейн и многие другие.
Как можно будет привиться?
Вакцинация «Спутником V» идет в Москве с 5 декабря, в регионах России — по-разному, где-то вакцин фактически нет или получить вакцину очень сложно. В отдельных учреждениях Минздрава вакцинация врачей стартовала уже в начале осени.
Что еще мы не знаем?
После публикации промежуточных результатов фазы III в журнале The Lancet вопросов к вакцине стало существенно меньше, чем раньше. На сегодня мы не знаем подробностей доклинических исследований на животных, не опубликован протокол исследования и результаты экспертной проверки, на основании которой вакцина была зарегистрирована в России. Федеральный закон 61-ФЗ требует от Минздрава публиковать экспертные заключения, на основе которых лекарство выходит на рынок, однако это требование до сих пор не исполняется. Большинство западных производителей вакцин опубликовали подробные протоколы своих исследований добровольно.
«ЭпиВакКорона» из центра «Вектор» Роспотребнадзора
- Тип: пептидная
- Эффективность: неизвестна, исследование эффективности началось 18 ноября
- Хранение: 2–8 °С — 6 месяцев
- Документы: инструкция, карточка препарата в ГРЛС
- Статус: зарегистрирована на условиях в России и Туркмении
- Особенности: помимо самих пептидов коронавируса содержит вспомогательные вещества: белок-носитель и адъювант на основе гидроксида алюминия
Что это?
Вакцина, состоящая из трех синтетических пептидов SARS-CoV-2, соединенных с белком-носителем и закрепленных на вспомогательном веществе (адъюванте) — гидроксиде алюминия.
Чем вакцина отличается от других?
Это единственная вакцина на основе пептидов, прошедшая дальше первой фазы клинических испытаний и даже получившая регистрацию (еще до начала испытаний эффективности и до завершения других клинических исследований). Как и всякая пептидная вакцина, она содержит только очень небольшие фрагменты вирусных белков, а значит, максимально подвержена изменчивости со стороны вируса, что может плохо повлиять на ее эффективность (если она вообще будет обнаружена).
На какие вакцины больше всего похожа?
Пептидных вакцин среди разрабатывающихся сейчас препаратов немного, самые близкие — вакцина Университета Тюбингена в Германии, вступившая в первую фазу исследований, и вакцины компании Neo7Logic и турецкого Университета Босфора (их пептидные препараты пока испытываются на животных).
Что с результатами испытаний?
Все, что публично известно об «ЭпиВакКороне», исчерпывается фактически двумя источниками: российским патентом и страничкой с «Часто задаваемыми вопросами» на сайте Роспотребнадзора. Важно напомнить, что ни патенты, ни странички «ЧаВо» не рецензируются независимыми учеными, в отличие от научных публикаций. 10 февраля 2021 года в пресс-службе Роспотребнадзора сообщили, что отправили статью с результатами клинических исследований своей вакцины фазы I—II в зарубежные научные рецензируемые журналы. Однако отправка статьи, конечно, не гарантирует ни самого факта, ни качества публикации.
К тому, что пишет «Вектор» в своем патенте, уже сейчас очень много вопросов: не понятно, по каким принципам отбирались пептиды и почему их последовательности не пересекаются с теми участками шиповидного белка, которые в наибольшей степени стимулируют образование нейтрализующих антител по другим работам. Не ясно, почему даже в экспериментах на животных сотрудники «Вектора» не определяли титр нейтрализующих антител, а ограничились общим титром. Почему в патенте не описаны эксперименты на приматах, обязательные и вроде бы проводившиеся до начала клинических исследований. Результаты испытаний I/II фазы пусть и отправлены в научные журналы, как написано выше, но о них ничего не известно, кроме того, что в них приняло участие 14 и 86 человек соответственно и «индукция специфических антител произошла у 100% добровольцев». Не понятно, почему у самоорганизовавшихся участников клинического исследования не обнаруживаются антитела никакими тест-системами, за исключением системы, которую рекомендует сам «Вектор». Все это само по себе не доказывает, что вакцина принципиально не способна работать, но требует подробных объяснений.
О том, как исследователи пытаются по обрывкам сообщений от Роспотребнадзора понять, что же представляет собой «ЭпиВакКорона», которой предлагается прививаться гражданам России, можно подробнее прочитать здесь.
Что с производством?
26 января премьер Михаил Мишустин выделил «Вектору» два миллиарда рублей на производство двух миллионов доз новой вакцины. 20 февраля на совещании правительственной комиссии он же сообщил, что к тому моменту всего было произведено 80 тысяч доз препарата (20 ноября «Вектор» рассказал «Интерфаксу», что на тот момент было сделано 15 тысяч доз вакцины, 11 декабря гендиректор «Вектора» Ринат Максютов заявил, что на предприятии произведено 50 тысяч доз).
Когда можно будет привиться?
Мы не знаем. Но точно не в Москве: пока московские власти не рассматривают другие вакцины, кроме «Спутника V».
Что еще мы не знаем?
Можно только повторить, что в научной литературе об «ЭпиВакКороне» не опубликовано совсем ничего.
«КовиВак» Центра им. Чумакова
- Тип: инактивированная
- Эффективность: неизвестна, испытания III фазы не начались
- Хранение: 2–8 °С — 6 месяцев
- Документы: инструкция, карточка в ГРЛС, карточка исследования I/II фазы на 600 человек
- Статус: зарегистрирована 20 февраля
Что это?
Вакцина на основе инактивированного («убитого») SARS-CoV-2 с гидроксидом алюминия в роли адъюванта. Доза — 0,5 миллилитра, 3 микрограмма инактивированного вируса, полученного в клеточных линиях Vero, в индивидуальном флаконе. Разрабатывается в Научном центре исследований и разработки иммунобиологических препаратов имени М. П. Чумакова.
Чем вакцина отличается от других?
Инактивация — самая старая, отработанная и испытанная технология создания вакцин. Сначала обычный вирус (тот же, что заражает людей) выращивается в клетках в биореакторах, затем инактивируется, в случае вакцины Центра им. Чумакова — химическим способом. От векторных и РНК-вакцин, которые в случае SARS-CoV-2 продвинулись в исследованиях дальше всего, инактивированные вакцины отличаются тем, что их компоненты не способны проникать в клетки и стимулировать активацию T-лимфоцитов, ограничиваясь производством антител. Тем не менее инактивированные вакцины до сих пор применяются для профилактики многих вирусных заболеваний. В том же Центре Чумакова делают вакцины для борьбы с энцефалитом и полиомиелитом.
На какие больше всего похожа?
Инактивированные вакцины в принципе всегда очень похожи друг на друга, так как содержат один и тот же основной компонент — сам вирус-возбудитель. Отличия касаются только механизмов инактивации: обезвредить вирус можно с помощью высокой температуры или разных химических веществ. Среди потенциальных конкурентов «КовиВака» можно назвать китайские, индийские и казахстанские инактивированные вакцины, которые разрабатывают Sinovac, Sinopharm, Bharat Biotech, Институт вирусологии города Ухань и другие организации.
Что с результатами испытаний?
Результаты доклинических испытаний, как и у всех российских вакцин, не опубликованы. Известно только, на каких животных они проводились: на мышах, мармозетках, кроликах и морских свинках. Некоторые подробности выяснили сотрудники сайта N+1, поговорив с создателями вакцины, — например, что после инъекции вырабатывалось «достаточное» количество антител.
По словам разработчиков, началась первая фаза клинических исследований, в которой должны принять участие 15 человек; во второй будет 200 добровольцев, из них 50 получат плацебо (в российском реестре разрешений на проведение исследований зарегистрировано одно исследование этой вакцины, включающей 600 добровольцев). III фаза клинических исследований запланирована на март 2021 года, и в ней примут участие 3000 человек.
Результаты испытаний пока не известны. Некоторые данные о нежелательных явлениях содержатся в инструкции. Там утверждается, что тяжелых системных реакций на вакцину зарегистрировано не было, а наиболее частой побочкой была боль в месте укола — она наблюдалась в 15% добровольцев (их абсолютное число не приводится).
Ничего не ясно относительно не только эффективности, но даже иммуногенности вакцины — то есть способности вызывать иммунную реакцию в форме выработки антител, активации Т-клеток и т. д. — тех параметров, которые обычно публикуются по результатам испытаний II фазы. Максимально подробные сведения, которые на сегодня есть, исчерпываются заявлением директора Центра им. Чумакова Айдара Ишмухаметова о том, что у 15% испытуемых на 28-й день вакцинации антитела не вырабатываются. 21 января он также говорил, что доля добровольцев, у которых появляются антитела после вакцинации, составляет 70% после первого укола и 90% после второго (источник противоречия «Медузе» неизвестен). Какой был детектирован при этом титр антител, как он был измерен, с какой погрешностью и кем — все это не ясно. Зато мы почему-то знаем, что в основу «КовиВака» лег штамм коронавируса, выделенный у одного из пациентов больницы в Коммунарке.
Что с производством?
Производство инактивированных вакцин ограничено теми предприятиями, где можно работать с самим «живым» SARS-CoV-2, то есть, скорее всего, делать вакцину будет только сам разработчик, Центр им. Чумакова. На 20 февраля, по словам премьер-министра Михаила Мишустина, в марте в промышленное производство будут запущены первые 120 тысяч доз вакцины. Всего в Центре предполагают выпускать по 10 миллионов доз вакцины в год с возможностью расширения, однако с какого момента это производство запустится в полную силу, не ясно.
Когда можно будет привиться?
Мы не знаем. 18 января Татьяна Голикова заявила, что начало вакцинации препаратом из Центра Чумакова можно ожидать в апреле 2021 года.
Что еще мы не знаем?
Многого. Прежде всего, насколько инактивированные вакцины в принципе подходят для предотвращения COVID-19. Так, эффективность очень похожей вакцины от китайской Sinopharm, составила 79,34%, от Sinovac — чуть больше 50%. Это существенно меньше, чем векторные и мРНК-вакцины.
Ad5-nCoV («Конвидеция») производства CanSino Biological
- Тип: аденовирусная
- Эффективность: неизвестна, испытания III фазы продолжаются
- Хранение: 2–8 °C
- Документы: карточки двух российских исследований, на 783 и 8000 человек
- Статус: зарегистрирована в Китае, Мексике и Пакистане
- Особенности: иностранная вакцина с локализованным в России производством, одна доза
Что это?
Китайская вакцина на основе человеческого аденовируса типа 5, схожая с вакциной «Спутник V», но состоящая всего из одного компонента. Несет тот же природный вариант S-белка. Испытывается не только в России, но и в Саудовской Аравии, Мексике и Пакистане. В России испытаниями и локализацией производства занимается компания «Петровакс».
Чем вакцина отличается от других?
Похожа на другие векторные аденовирусные вакцины, однако аденовирус, на основе которого сделана эта вакцина, — один из самых распространенных в мире. Потенциально это может способствовать сниженной эффективности вакцины для людей, которые этим типом аденовируса уже переболели. Для решения этой проблемы другие производители стараются использовать либо аденовирусы животных (например, приматов), либо более редкие типы аденовируса, или же прибегают к повторной вакцинации. Впрочем, насколько это практически повлияет на эффективность вакцинации, сейчас непонятно. Это станет известно только по результатам исследования.
На какие больше всего похожа?
На все остальные векторные вакцины на основе аденовирусов.
Что с результатами испытаний?
Вакцина показала обнадеживающие результаты в исследованиях первой (108 человек) и второй фазы (508 человек) исследований. У добровольцев вырабатывались нейтрализующие антитела, однако напрямую сравнивать результаты иммунного ответа на вакцины разных производителей невозможно. Сами разработчики в статье с результатами этих испытаний называют иммунный ответ после единичной вакцинации «значительным».
В «Петроваксе» «Медузе» пояснили, что на данный момент в российском реестре клинических исследований зарегистрировано два исследования. Первое, в котором участвуют несколько сотен добровольцев, уже завершено — об этом сообщил Николай Додонов в интервью Bloomberg. На середину января обработаны данные по 200 добровольцам, у 149 из них выработались антитела. Кроме того, Додонов заявил, что Россия может стать первой страной, где препарат CanSino Biological будет зарегистрирован (в самом Китае применение вакцины сейчас ограничено военными).
Защитная роль вакцины будет оцениваться по результатам второго испытания, в котором примут участие уже восемь тысяч человек из России и которое станет частью большого международного исследования на 40 тысяч добровольцев (идет в Мексике, Пакистане и Чили). Анализ эффективности, по словам научного советника «Петровакса» Антона Тихонова, планируется проводить после того, как заболеют примерно 150 участников исследования — из числа тех, что получили плацебо, и, возможно, тех, что получили настоящую вакцину.
14 января стали известны промежуточные результаты локального исследования III фазы. Результаты, по словам представителя «Петровакса», который пообщался с «Интерфаксом», «показали высокий профиль безопасности и эффективности вакцины Ad5-nCoV („Конвидеция“). Уже проанализированы данные 200 добровольцев из 500 провакцинированных, результаты эффективности показали — у 92,5% добровольцев выработались высокие титры антител к COVID-19». Публикация результатов обоих клинических испытаний пока только ожидается.
Кроме того, в «Петроваксе» планируют провести совместное с РФПИ исследование комбинации «Спутника V» с «Конвиденцией» — последнюю планируют использовать в качестве второго компонента вакцины Центра Гамалеи, на которую она очень похожа.
Что с производством?
По словам Тихонова, производство вакцины будет частично локализовано в России и будет проходить на основе импортируемой из Китая субстанции. Подготовка к производственному процессу уже началась, однако о сроках поставок в компании не говорят. Теоретически мощности предприятия позволяют производить более 160 миллионов доз иммунобиологических препаратов в год.
Когда можно будет привиться?
Мы не знаем.
Что еще мы не знаем?
Отличительной особенностью Ad5-nCoV является однократная иммунизация, которая может оказаться недостаточной.
Вакцина AstraZeneca и Оксфордского университета
- Тип: аденовирусная
- Эффективность: 82,4% в случае двух доз с промежутком в 12 недель
- Хранение: 2–8 °C — 6 месяцев
- Документы: публикация по результатам II/III фазы
- Зарегистрирована: Алжир, Аргентина, Австралия, Бангладеш, Бразилия, Бутан, Доминиканская Республика, Египет, Европейский союз, Исландия, Индия, Ирак, Кувейт, Мальдивские острова, Мексика, Марокко, Монголия, Непал, Норвегия, Пакистан, Сейшельские острова, Сальвадор, Шри-Ланка, Южная Африка, Южная Корея, Таиланд, Соединенное Королевство, Филиппины, Чили
- Особенности: иностранная вакцина с локализованным в России производством
Что это?
Векторная вакцина (с техническим названием AZD1222 и торговым Covishield — в Индии) на основе аденовируса шимпанзе (ChAdOx1). Предусмотрено две одинаковые инъекции с перерывом в 28 дней (по оригинальному протоколу) или больше (по последним данным, это может оказаться более эффективным)
Чем вакцина отличается от других?
Это единственная вакцина на основе аденовирусов шимпанзе, добравшаяся до III фазы исследований. Использование именно такого вектора потенциально может сделать вакцину более эффективной у тех, кто уже имеет иммунитет к аденовирусам человека.
На какие больше всего похожа?
На вакцину ReiThera/LEUKOCARE/Univercells на основе аденовируса горилл. Но до клинических испытаний этой вакцины дело пока не дошло.
Что с результатами испытаний?
Клинические исследования I/II фазы опубликованы, они показали появление нейтрализующих антител у всех испытуемых. Результаты фазы III ожидались лишь в конце декабря, но несмотря на трудности стали известны из пресс-релиза компании уже 23 ноября. Эффективность составила 90% в случае, когда добровольцы при первом уколе получали только половину дозы. Если же обе прививки делались полной дозой, эффективность достигала всего 62%. Анализ проводился при 131 заболевшем (разбивки по заболевшим в разных группах пока нет — ее можно будет ожидать в обещанной научной публикации). Важно отметить, что тяжелобольных в группе вакцинированных не было, как и не было замечено серьезных побочных эффектов.
1 февраля исследователи опубликовали препринт, где были проанализированы новые данные по клиническим исследованиям в Великобритании, — согласно ему, при увеличении окна между первой и второй дозой эффективность вакцины может быть выше: 82,4%, если окно больше 12 недель, против 54,9% в случае окна меньше шести недель.
Клинические исследования III фазы проходят в том числе в России, запланировано участие всего 150 добровольцев. Это отдельные, дополнительные испытания безопасности и иммуногенности на российской популяции — на мировые исследования эффективности оно влиять не будет. Всего в мире к участию в исследовании планируется привлечь 60 тысяч человек.
Плохие новости относительно вакцины AstraZeneca пришли в середине февраля из ЮАР — в связи с распространением южноафриканского штамма 501Y.V2. там эффективность вакцины оказалась очень низкой, менее 25%.
Что с производством?
Что происходит с производством в целом и планируются ли поставки вакцины в Россию, мы не знаем. Однако Великобритания еще в мае заключила договор с компанией на поставку 100 миллионов доз, ожидая около 30 миллионов доз еще к сентябрю. Судя по последним новостям, эти планы пока не выполняются. Впрочем, в этом предварительном исследовании принимали участие всего 2000 человек.
Когда можно будет привиться?
В пресс-релизе о результатах III фазы компания приводит карту с ожидаемыми датами поставки вакцин в разные страны. Согласно этой карте (.pdf), в Россию вакцина попадет в июле 2021 года через компанию «Р-фарм». Ранее аналитическая компания Torreya предполагала, что массовая вакцинация начнется в июне 2021 года.
Что еще мы не знаем?
Прежде всего, мы пока не знаем, доберется ли все-таки вакцина до России или нет.
Следующая часть путеводителя касается вакцин, недоступных для россиян, и требует обновления
Мировые вакцины, дошедшие до III фазы исследований
Pfizer/BioNTech
Что это?
Вакцина на основе искусственно синтезированной матричной РНК, упакованной в липидные пузырьки, — проникая в клетку, нуклеиновая кислота, как и РНК настоящего вируса, стимулирует производство S-белка. Исходно в BioNTech испытывали две версии вакцины, BNT162b1 и BNT162b2, и именно вторая была признана более удачной из-за меньшей частоты побочных эффектов. В ней, как и в большинстве аденовирусных вакцин, присутствует обычная природная версия S-белка, только с небольшими точечными изменениями.
Чем вакцина отличается от других?
Вакцины на основе мРНК впервые испытываются на людях, до сих пор эта технология только разрабатывалась. РНК сама по себе довольно нестабильна, липидные пузырьки, видимо, тоже — все это отражается на том, что эту вакцину требуется хранить в условиях глубокой заморозки, при минус 70 градусах Цельсия (эта температура достижима в специальных холодильниках и при использовании сухого льда). В последнем пресс-релизе компании заявили, что пытаются решить эту проблему созданием специальных холодильников c мобильным отслеживанием, которые потребуют «перезарядки» сухим льдом всего раз в 15 дней.
На какие больше всего похожа?
Из тех, что дошли до III фазы, — на вакцину Moderna. Вообще же основанных на РНК вакцин довольно много. В том числе таких, которые несут измененные версии S-белка.
Что с результатами испытаний?
Это первая в мире вакцина с завершенным исследованием эффективности — 18 ноября в Pfizer/BioNTech заявили о достижении эффективности в 95%. По результатам исследования из группы плацебо заболело 162 человека, при этом в группе вакцинированных таких оказалось всего восемь (один — тяжелый). Утверждается, что эффективность не зависела от возраста, пола, и расы добровольцев. Отдельно отмечается, что в группе 65+ эффективность составила свыше 94% (по результатам первых фаз в этом были сомнения). Серьезных побочных эффектов пока не обнаружилось, преимущественно это слабость и головная боль, однако наблюдения будут продолжаться.
Компания уже подала заявку на регистрацию в США по экстренной процедуре EUA. 2 декабря вакцина была подобным образом зарегистрирована в первой западной стране — Великобритании. Вакцинация там уже началась.
Что с производством?
На 18 ноября компании рассчитывают произвести во всем мире до 50 миллионов доз вакцин в 2020 году и до 1,3 миллиарда доз к концу 2021 года. Исследования проходили в США, Германии, Турции, ЮАР, Бразилии и Аргентине — можно ожидать, что именно эти страны получат вакцину быстрее остальных.
Что еще мы не знаем?
Главное неизвестное — будет ли вакцина доступна в России и когда. 17 ноября официальный представитель компании сообщил, что сейчас рассматривается возможность подачи заявки на регистрацию. Как и с другими вакцинами, эпидемиологов также интересует, создает ли она стерилизующий иммунитет. Грубо говоря, есть два варианта: в первом вакцина может защищать вакцинированного от появления симптомов, но такой человек по-прежнему может инфицироваться и заражать других. В другом, более удачном варианте, вакцина может предотвращать не только развитие симптомов, но и возможность размножения вируса в организме.
Вакцина Moderna/NIH
Что это?
РНК-вакцина (mRNA-1273), крайне похожая на BNT162b2 от Pfizer/BioNTech. Содержит генетический материал того же природного S-белка коронавируса, причем с теми же небольшими измерениями.
Чем вакцина отличается от других?
Насколько можно судить по открытым источникам, отличия между РНК-вакцинами двух производителей минимальны и, скоре всего, касаются «упаковки» РНК-молекул. Однако они отражаются на температуре хранения: 16 ноября компания объявила, что до 30 дней препарат можно хранить при 2–8 градусах Цельсия, что, конечно, должно упростить дистрибуцию по сравнению с вакциной Pfizer/BioNTech, которой требуются холодильники глубокой заморозки.
Что с результатами испытаний?
30 ноября, после набора 196 заболевших добровольцев, компания подала документы на экстренную регистрацию вакцины в FDA и Европейское медицинское агентство. Постепенно рассматривать документы также начали в Швейцарии, Канаде, Великобритании, Израиле, Сингапуре и ВОЗ. Если экстренная регистрация пройдет успешно, первые вакцинации можно ждать уже в конце декабря 2020 года. Заседание комиссии по вакцинам в FDA запланировано на 17 декабря.
Оценка эффективности вакцины после последнего анализа была уточнена до 94.1% (по результатам первого сообщалось об эффективности в 94,5%). Среди заболевших только 11 человек оказалось в группе вакцинированных, остальные — в группе плацебо. В отличие от случая Pfizer/BioNTech, ни одного тяжелого заболевания в группе вакцинированных не было. Также впервые в компании уточнили, что среди 196 заболевших есть люди старше 65 лет, таких оказалось 33 человека.
Что с производством?
В компании обещают произвести к концу 2020 года 20 миллионов доз для США, это в 2,5 раза меньше, чем планируют Pfizer/BioNTech. В планах на 2021 год пока от 500 миллионов до миллиарда доз препарата. Поскольку вакцинация проводится в два этапа, это означает, что производимых объемов должно хватить для 10 миллионов человек. 11 августа правительство Соединенных Штатов выделило компании дополнительно 1,5 миллиарда долларов в обмен на 100 миллионов доз вакцины, если та окажется безопасной и эффективной. Moderna заключила аналогичные сделки с Канадой, Японией и Катаром. 25 ноября было объявлено о договоре на поставку 160 миллионов доз вакцины в ЕС.
Что еще мы не знаем?
Того же самого, что и в случае Pfizer/BioNTech: будет ли вакцина доступна для россиян.
Вакцина Novavax
Что это?
Единственная из дошедших до III фазы вакцина субъединичного типа — то есть вакцина, содержащая сам S-белок, а не генетические «инструкции» к его производству.
Чем вакцина отличается от других?
S-белок в вакцине находится в форме агрегатов, который производитель называет наночастицами. Также в составе вакцины используется специальный адъювант, который, видимо, играет важную роль в стимулировании иммунного ответа — в версии без него выработки антител при вакцинации почти не наблюдалось. Интересно, что вирусный белок для вакцины производят в клетках насекомых — а именно кукурузной совки.
На какие больше всего похожа?
На вакцину Sanofi Pasteur / GSK — впрочем, в отличие от вакцины Novavax, эта и другие субъединичные вакцины пока находятся на ранних стадиях исследования.
Что с результатами испытаний?
Опубликованы результаты испытаний иммуногенности, в которых принял участие 131 человек. В составе с адъювантом вакцина показала очень высокий средний титр нейтрализующих антител у добровольцев. По мнению известного иммунолога Флориана Краммера, субъединичные вакцины в целом для COVID-19 дают наилучшие результаты по этому параметру. Третья фаза исследований, в которой должна будет стать известна эффективность вакцины, началась в конце августа, ее результаты пока не известны, их можно ожидать к началу 2021 года.
Что с производством?
Компания планирует производить по два миллиарда доз вакцины в год. На сегодняшний день поставки планируются в США, Великобританию, Канаду и Австралию, через партнеров — в Японию, Индию и Южную Корею. Австралия, например, договорилась о поставке 40 миллионов доз уже в первой половине 2021 года — если, конечно, испытания завершатся успешно.
Что еще мы не знаем?
Главный вопрос — будет ли вакцина доступна для россиян. Также плохо ясны реальные объемы поставок, так как производство рекомбинантных белков в больших количествах может быть сопряжено с трудностями.
Johnson & Johnson
Что это?
Векторная вакцина на основе аденовируса человека типа 26 (Ad26.COV2.S).
Чем вакцина отличается от других?
Наряду с вакциной CanSino Bio (и некоторыми другими, находящимися на ранних фазах испытаний), это еще одна вакцина с однократной иммунизацией. Впрочем, одновременно с такой схемой стартовало и исследование эффективности двукратной схемы — будет ли эффективность однократной иммунизации существенно ниже двукратной, пока не ясно.
На какие больше всего похожа?
На первый компонент вакцины «Спутник V» и другие векторные вакцины.
Что с результатами испытаний?
Опубликованы результаты исследований на животных и итоги первых испытаний на добровольцах. Результаты хорошие, примерно такие же, как и у других векторных вакцин. Новостей по исследованиям эффективности пока нет — за исключением того, что в октябре их потребовалось прерывать из-за болезни добровольца (какой именно болезни — не ясно, как и то, входил ли заболевший в группу плацебо). Через несколько дней исследование продолжилось.
Что с производством?
США еще в августе договорились на 100 миллионов доз, Евросоюз — на 200 миллионов в октябре (сколько человек может этим количеством вакцинироваться, будет зависеть от результатов исследований). Аналитическая компания Torreya предполагает, что массовая вакцинация начнется в июле 2021 года.
Что еще мы не знаем?
Главный вопрос — будет ли вакцина доступна для россиян. Отдельный интерес представляет необходимость во второй вакцинации — если она не потребуется, это позволить существенно упростить дистрибуцию вакцины.
Sinovac и другие инактивированные вакцины из Китая и Индии
Что это?
Вакцины, сделанные по самой старой технологии из «убитого» (инактивированного) природного вируса. Поскольку вирусы в данном случае одинаковы, различия в вакцинах касаются только тонкостей способов инактивации и дозирования.
Чем вакцины отличаются от других?
Производство таких вакцин требует лицензирования по высокому классу биобезопасности так как производитель работает с «живым» вирусом, а не его белками или РНК. Кроме того, инактивированные вакцины пока в среднем дают не самые выдающиеся результаты по уровню вырабатываемых у добровольцев антител.
На какие больше всего похожи?
Из российских — на вакцину, создаваемую в Центре им. Чумакова.
Что с результатами испытаний?
Sinovac Biotech была первой компанией, испытавшей вакцину от SARS-CoV-2 на приматах — по данным разработчиков, антитела у животных вырабатывались слабо, но количество вируса было сильно снижено по сравнению с группой плацебо. Эта же вакцина стала первой среди инактивированных, по которой появились данные об эффективности — 9 декабря власти ОАЭ объявили в пресс-релизе о результатах той части испытаний, которая проходила на территории страны. Согласно сообщению, эффективность составила 86%, при этом у 99% вакцинированных вырабатывались антитела. Серьезный нежелательных явлений зафиксировано не было. В исследовании приняло участие 31 тысяча добровольцев. Ни общего числа заболевших, ни разбивки по группам в сообщении не было указано, как и других важных подробностей.
Что с производством?
В разработке участвует множество компаний в разных странах, поэтому цельную картину дать сложно.
Что еще мы не знаем?
Будут ли поставляться любые инактивированные вакцины в Россию или эту нишу займет Центр им. Чумакова.
А что же все остальные вакцины?
Их очень много: 48 дошли до клинических исследований, еще 164 кандидата находятся на стадии доклиники. Среди них есть довольно необычные: например, в форме спрея (что потенциально лучше, чем инъекции, из-за выработки «ранних» антител класса IgA на поверхности слизистых, которые являются первой мишенью для атаки коронавируса) и даже такие, которые сделаны на основе способного к размножению вируса (что теоретически может сделать иммунитет более стойким). Для получения общей картины можно:
- обратиться к обновляемой вакцинной карте ВОЗ
- прочитать фундаментальный обзор разрабатывающихся вакцин от Флориана Краммера в Nature
- следить за экраном «Коронавирус» и обновлять этот материал — при появлении результатов по новым перспективным вакцинам он будет дополняться.
Все материалы «Медузы» о коронавирусе открыты для распространения по лицензии Creative Commons CC BY. Вы можете их перепечатать! На фотографии лицензия не распространяется.
Александр Ершов при участии Светланы Рейтер и Даниила Давыдова
(1) Аденовирус
Один из распространенных в человеческой популяции вирусов, вызывающих простуду. На его основе разрабатывают не только вакцины, но и генетические препараты.
(2) S-белок, он же спайк
Тот самый белок, с помощью которого коронавирус соединяется с одним из поверхностных белков в человеческих клетках. 90% всех нейтрализующих антител вырабатываются именно на S-белок. Такие антитела способны подавлять инфицирование клеток человека благодаря тому, что лишают вирус свободных «ворот» для соединения с клетками.
(3) Т-лимфоциты
Особая популяция лимфоцитов, созревающая в тимусе и играющая ключевую роль в противовирусной защите организма.
(4) Пептиды
Пептиды — это просто фрагменты белков. Или, если угодно, соединения нескольких аминокислот.
(5) Пептиды
Пептиды — это просто фрагменты белков. Или, если угодно, соединения нескольких аминокислот.
(6) Т-лимфоциты
Особая популяция лимфоцитов, созревающая в тимусе и играющая ключевую роль в противовирусной защите организма.
(7) Матричная РНК, мРНК
Это РНК, в которой закодирована последовательность белка.(8) Нейтрализующие антитела
Такие антитела, которые способны нейтрализовать вирус — то есть лишить его способности проникать в клетки человека. 90% всех нейтрализующих антител вырабатываются на S-белок.
(9) Иммуногенность и эффективность
При разработке вакцин сначала исследуется иммуногенность препарата: вызывает ли он выработку специфических антител, нейтрализующих антител, активацию Т-клеток и так далее. Хороший результат на этой стадии косвенно указывает на то, что добровольцы оказываются защищены от заболевания. Но непосредственно уровень защиты измеряется на последней, III фазе, когда замеряется риск заболеть в вакцинированной группе и группе плацебо. Эффективность и риск вычисляются на основе сравнения числа заболевших среди групп.
(10) Препринт
Нерецензированная рукопись научной статьи.(11) 82,4%
Доверительный интервал 95%-й вероятности в пределах 62,7–91,7%
(12) 54,9%
Доверительный интервал 95%-й вероятности в пределах 32,7–69,7%
(13) Матричная РНК
Это РНК, в которой закодирована последовательность белка. В данном случае — S-белка.
(14) Липидные пузырьки
Это пузырьки из липидов — природных жиров и жироподобных веществ.
(15) S-белок, он же спайк
Тот самый белок, с помощью которого коронавирус соединяется с одним из поверхностных белков в человеческих клетках. 90% всех нейтрализующих антител вырабатываются именно на S-белок. Такие антитела способны подавлять инфицирование клеток человека благодаря тому, что лишают вирус свободных «ворот» для соединения с клетками.
(16) Какими изменениями?
В BNT162b2 содержится мРНК, кодирующая природный S-белок SARS-CoV-2. Однако в нем точечно заменены некоторые аминокислоты на аминокислоту пролин. Это фиксирует S-белок в таком положении, в котором он находится на поверхности вируса до слияния с клеткой, — предполагается, что такая конформация позволит образовать больше нейтрализующих антител к вирусным частицам.
(17) Матричная РНК, мРНК
Это РНК, в которой закодирована последовательность белка.(18) EUA
Emergency use authorization — разрешение на использование лекарственного препарата в экстренных условиях; временный статус, который выдается на период чрезвычайного события (например, пандемии) и предполагает распространение лекарства под контролем государства.(19) S-белок
Шиповидный белок, который коронавирус использует для входа в клетку в процессе инфекции.(20) S-белок
Шиповидный белок, который коронавирус использует для входа в клетку в процессе инфекции.(21) Что за адъювант?
Вещество на основе мыльных веществ сапонинов под торговым названием Matrix-M.
(22) Рекомбинантный
Рекомбинантный белок — такой, который производится в чужеродном организме. Например, белок человека, синтезированный в бактерии.