
Женщина, пострадавшая в брюссельском теракте в 2016 году, несколько лет безуспешно боролась с инфекцией после ранения Рассказываем о методе терапии вирусами, который смог ей помочь
Мы рассказываем честно не только про войну. Скачайте приложение.
17 января 2022 года в научном журнале Nature Communications вышла статья, в которой врачи рассказали, как они лечили пациентку после теракта в брюссельском аэропорту в 2016 году. У пострадавшей была тяжелая инфекция в месте перелома, которая не проходила годами. Антибиотики ей не помогали, и врачи решили использовать так называемую фаговую терапию. Это сложный и персонализированный метод борьбы с бактериальными инфекциями, пионером которого почти сто лет назад стал ученый из Тбилиси Георгий Элиава. С появлением антибиотиков фаговая терапия была практически забыта, и только сейчас, на новом уровне развития медицины (и с ростом устойчивости бактерий к антибиотикам) начинает возрождаться снова. «Медуза» рассказывает, что это за терапия и как она помогла бельгийской пациентке.
В 2016 году во время террористического акта в брюссельском аэропорту пострадало более сотни человек. Одной из них была тридцатилетняя женщина, которую доставили в госпиталь Эрасме. Несмотря на остановку сердца и существенные кровопотери, после реанимационных действий, частичной ампутации подвздошной кости и фиксации бедренной кости, состояние пациентки оценили как стабильное. Однако спустя четыре дня у нее начался септический шок, хотя она с самого начала принимала антибиотики (амоксициллин/клавуланат, а затем пиперациллин/тазобактам). В образце, взятом из воспаленных тканей, обнаружились бактерии Enterococcus faecium, Pseudomonas aeruginosa, Enterobacter cloacae и Klebsiella pneumoniae. Врачи начали долгий курс терапии высокими дозами антибиотиков широкого спектра действия — в общей сложности он продлился более двух лет.
У пациентки возникали нежелательные реакции на прием антибиотиков, поэтому препараты приходилось отменять и заменять. Фрагмент пересаженного участка мышцы стал отмирать (возник некроз), у пациентки развивалась фебрильная нейтропения, глухота, ренальная тубулопатия, а спустя 25 дней у нее также диагностировали мукормикоз. От последней инфекции ее вылечили противогрибковыми препаратами; некротизированные участки тканей удалили. В последующие месяцы, однако, врачам не удалось избавиться от воспаления. Спустя 170 дней в образцах, взятых около хирургических конструктов, поддерживающих ткани, все еще обнаруживались бактерии: Klebsiella pneumoniae, Staphylococcus aureus и Mycobacterium xenopi. Предполагалось, что ситуацию ухудшали мелкие фрагменты костей и осколки взрывного устройства, оставшиеся в ноге.
Антибиотики стали подбирать заново, но справиться с инфекцией так и не удалось: основной проблемой была бактерия Klebsiella pneumoniae. И именно тогда, в качестве экспериментального и практически последнего средства врачи решили попробовать фаговую терапию, для чего обратились к коллегам из Института бактериофагов, микробиологии и вирусологии имени Георгия Элиавы в Тбилиси.
Фаговая терапия зародилась в Советском Союзе
Бактериофаги — это вирусы бактерий. Точно так же, как вирусы человека проникают и размножаются в клетках человека, бактериофаги инфицируют и затем уничтожают бактерии. Бактериальные клетки, в отличие от человеческих, имеют довольно большую стенку, поэтому бактериофаги обычно отличаются от «известных» вирусов своим внешним видом — они часто напоминают микроскопический шприц, способный связаться с клеткой и впрыснуть в нее генетический материал (ДНК или РНК). Поскольку фаги — естественные враги бактерий, то практически сразу после их открытия в начале XX века стало ясно, что, теоретически, эти вирусы можно использовать для борьбы с бактериальными инфекциями.
Одним из основоположников фаговой терапии был грузинский микробиолог Георгий Элиава. В 1923 году он основал в Тбилиси институт — первый в мире научно-исследовательский центр по изучению бактериофагов. Вместе с ним также работал и первооткрыватель бактериофагов — француз Феликс ДʼЭрелль. В 1937 году по неизвестным причинам Элиава был расстрелян как «враг народа».

Фагами начали интересоваться фармацевтические компании, в том числе американские. Однако исследования в этой области сильно затормозилось из-за начала промышленного производства пенициллина в 1940-х годах: казалось, антибиотики окончательно решили проблему бактериальных инфекций. Через некоторое время, однако, выяснилось, что бактерии умеют приобретать устойчивость к антибиотикам. В последние годы исследователи и врачи постепенно возвращаются к мысли о ценности фаготерапии.
Сложность этого метода состоит в том, что конкретные фаги часто способны бороться лишь с конкретными штаммами бактерий. Поэтому пациентам нужно индивидуально подбирать вирус. Для этого различные фаги подселяют к культурам бактерий, взятым у пациентов, и смотрят, какая разновидность работает лучше всего. Как сообщают авторы недавно вышедшей статьи в Nature Communications, в последние десять лет такой подход успешно применялся в разных областях медицины, в том числе при лечении инфекций, возникающих при использовании ортопедических конструкций.
При этом специалистам, которые занимаются отбором фагов, важно обращать внимание на то, чтобы эти вирусы не имели генов, способных привести к устойчивости к антибиотикам и токсичности для организма.
В то же время узкую специфичность бактериофагов можно отнести к плюсам: если антибиотики чаще всего убивают и «полезную» микрофлору организма, вирусы действуют прицельно и не должны вызвать нежелательных реакций.
Бактерии, устойчивые к антибиотикам, стали особенно опасны для людей при переломах костей
Экспериментальня фаговая терапия, кажется, особенна полезна в самых сложных случаях — когда устойчивые к антибиотикам бактерии не просто заражают организм, а образуют собственные сообщества, биопленки. Биопленки — это особые плотные структуры которые умеют создавать некоторые колонии бактерий. Биопленки особенно устойчивы к антибиотикам и приносят человеку вред, если возникают внутри организма или «облепляют» медицинское оборудование, лабораторные приборы, канализационные трубы и другие поверхности.
В последнее время врачи все чаще начали сталкиваться со случаями, когда при лечении перелома кости у пациента развивается инфекция, которая почти не поддается воздействию доступных лекарств. Ее сокращенно называют FRI — fracture-related infection, то есть инфекция, связанная с переломом. Одна из бактерий, которая вызывает такие последствия, — Klebsiella pneumoniae. Этот вид умеет избегать иммунного ответа организма, быстро приобретает новые гены, обеспечивающие устойчивость к антибиотикам, а также способен формировать биопленки.
Если биопленка начинает формироваться там, где была сломана кость, то лечение оказывается очень трудным — может начаться сепсис, больному приходится давать большие дозы антибиотиков широкого спектра действия, и зачастую курс их приема растягивается на месяцы, если вообще помогает. Такое лечение вредно для собственной микрофлоры организма и порой приводит к необратимым последствиям.
Терапия специально подобранным фагом дала результат уже за пару дней
Фаг, который в итоге справился с терапией инфекции у жертвы террористической атаки в Бельгии, пришел из Грузии. Специалисты Института бактериофагов, микробиологии и вирусологии имени Георгия Элиавы получили его из образцов канализационных вод Тбилиси. При скрининге этот фаг с формальным обозначением vB_KpnM_M1 (M1), продемонстрировал наибольшую эффективность в борьбе с Klebsiella pneumoniae. Когда его вносили в культуру бактерий, выделенных у пациентки, уже через 35 минут вирус попадал в клетку, начиналась его репликация, и затем в течение 8–10 минут наступало разрушение бактериальных клеток.
Вирусологи провели 15 раундов эволюции фага по методу Аппельмана, благодаря чему устойчивость бактерий к этому вирусу существенно снизилась — в культуре не появлялись устойчивые колонии даже спустя несколько часов взаимодействия вируса и бактерии.
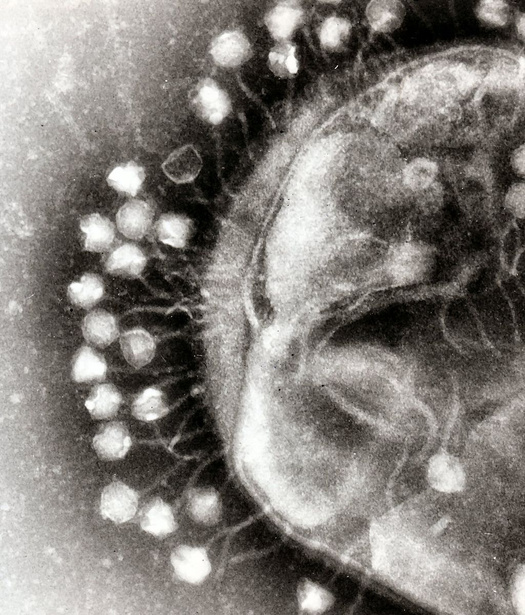
Этический комитет бельгийской больницы одобрил такое применение экспериментальной фаговой терапии еще в ноябре 2016 года, а пациентка тогда же подписала информированное согласие на лечение. Однако ее врачи долго не могли прийти к консенсусу по поводу того, можно ли применять такую терапию. И лишь в феврале 2018 года (спустя 702 дня после теракта), когда окончательно стало понятно, что антибиотики не работают, врачи приняли решение начать фаговую терапию. Она сопровождалась очередным хирургическим вмешательством и трансплантацией собственных костей пациентки, пропитанных антибиотиком рифампицином, в место инфекции. Поскольку согласие по поводу внутривенного введения вируса среди врачей не было достигнуто, и, вообще, фармакологические данные по этому виду терапии были крайне скудны, фаг вводили в организм пациентки с помощью катетера непосредственно к месту воспаления. Курс терапии на всякий случай ограничили шестью днями. Антибиотики при этом вводить не прекращали.
В итоге такая терапия, основанная на фаге, а также антибиотиках (использовались меропенем, колистин, а впоследствии также цефтазидим/авибактам) привела к значительному улучшению состояния раны, а также к улучшению общего состояния пациентки.
Эффект был заметен уже на второй день терапии. Тем не менее антибиотики и сопутствующие препараты продолжали менять в зависимости от новых доступных средств и возникающих от них побочных эффектов. В частности, в распоряжении врачей появился цефтазидим/авибактам, к которому последняя культура Klebsiella pneumoniae продемонстрировала чувствительность; его начали давать спустя два дня после первого введения фага.
Спустя три месяца врачи оценили прогресс лечения. Гноя и некротизированных участков больше не было — врачи пришли к выводу, что воспаление удалось победить. Более того, пациентка обрела мышечный контроль над левым бедром, прибавила в весе и чувствовала себя лучше. Анализ крови не выявил патологий, компьютерная томография ноги показала частичное восстановление бедренной кости. Было принято решение прекратить курс антибиотиков. Внешний фиксатор кости удалили спустя еще неделю. Фрагменты кости, которые отделились вместе с ним, собрали и посеяли для анализа бактериальной составляющей. Роста бактериальных культур в этих образцах не наблюдалось.
Судя по всему, бактериофаги работают лишь в паре с антибиотиками
К моменту введения фага штамм Klebsiella pneumoniae был устойчив ко всем доступным антибиотикам (кроме, как выяснилось, цефтазидима/авибактама). Исследователи изучили его геном и установили, что бактерия принадлежит к группе ST893, которая вызвала волну заболеваний в Иране в 2014–2016 годах.
У этой бактерии было множество генов устойчивости к антибиотикам, часто в нескольких копиях. Анализ мутаций показал, что она активно менялась внутри организма человека, подстраиваясь под новые условия лечения. Тем не менее это не помогло ей справиться с очередным методом лечения, который включал фаговую терапию.
В лабораторных экспериментах на культурах клеток было показано, что комбинация из фага и антибиотиков лучше всего справляется с плотными биопленками, образованными Klebsiella pneumoniae. Сами по себе ни антибиотик, ни фаг полностью справиться с ними не могли. Сходный результат получили и для бактерий, плавающих в растворе (они не образовывали биопленки, но также были опасными для человека). Наилучшей комбинацией для борьбы с ними оказались фаг, цефтазидим/авибактам и меропенем.
К похожим выводам уже приходили другие ученые, работающие, например, с мышами, где стафилококковую инфекцию удавалось победить с помощью комбинации из фага и препарата линезолид. Также было показано, что фаги умеют выводить бактерий из состояния биопленок и затем уничтожать их. Клинического успеха с помощью фаговой терапии удалось добиться для пациента с биопленками Klebsiella pneumoniae, нараставшими в искусственном коленном суставе. Комбинация специфичного фага и цефтазидима помогла справиться с воспалением вокруг импланта в аорте пациента. Теперь также известно, что некоторые фаги умеют отключать устойчивость бактерии к антибиотикам и могут служить, таким образом «троянским конем», который освобождает дорогу лекарственному препарату.
Исследователи отмечают, что «фаговые коктейли», которые разрабатывают многие западные компании, показали в недавних клинических испытаниях свою относительную неэффективность; причиной этому может быть неспецифичность используемых фагов к соответствующим инфекциям, а также процесс антагонистической коэволюции. Ученые полагают, что именно комбинация из индивидуальных, специфически подобранных фагов и антибиотиков может помочь сделать новый шаг в лечении инфекций, возникающих в результате хирургических вмешательств.
Анна Казнадзей
(1) Подвздошная кость
Часть тазовой кости.
(2) Септический шок
Жизнеугрожающая реакция организма на инфекцию. В этом случае отказывают органы и падает артериальное давление.
(3) Фебрильная нейтропения
Состояние, при котором у человека высокая температура и низкий уровень нейтрофилов — клеток крови, борющихся с инфекциями.
(4) Ренальная тубулопатия
Нарушение работы почек, при котором почечные канальцы плохо выполняют свою работу по поддержанию баланса жидкости и электролитов.
(5) Мукормикоз
Инфекция, которую вызывают грибы семейства мукоровые. Она встречается редко, но вызывает серьезные проблемы. Обычно инфекция затрагивает тяжелобольных пациентов и может поражать кожу, легкие, желудочно-кишечный тракт и другие системы организма.
(6) Какие?
Гены, которые кодируют бета-лактамазу и карбапенемазу, то есть ферменты, блокирующие работу целой группы антибиотиков (бета-лактамов), в которую входят цефалоспорины и пенициллины.
(7) Что это за фаг?
Полногеномное секвенирование показало, что он принадлежит к роду Slopekvirus из семейства Myoviridae.
(8) Метод Аппельмана
Метод, при котором фаги помещаются в среду с бактериями, устойчивыми к ним, и постепенно, пока не установленным способом, приобретают способность разрушать бактериальные клетки.
(9) Антагонистическая коэволюция
Совместная эволюция, при которой у двух противоборствующих эволюционирующих агентов изменения имеют противоположные направления. Например, бактерии становятся более устойчивыми к фагам, а фаги развивают свою способность инфицировать бактерии.