
Боль — это жизнь Лауреаты Нобелевской премии по физиологии и медицине объяснили, откуда берутся самые ужасные и самые приятные ощущения — жара, холод, боль, нежное прикосновение
Мы говорим как есть не только про политику. Скачайте приложение.
В 2021 году лауреатами Нобелевской премии по физиологии и медицине стали профессор Университета Калифорнии Давид Джулиус и профессор Центра Скриппса (США) Ардем Патапутян. Награду нынешние лауреаты получили, согласно формулировке Нобелевского комитета, «за открытие рецепторов температуры и прикосновения».
О чем вообще речь?
За короткой формулировкой Нобелевского комитета стоят 25 лет работы, полной прорывных идей и тонких экспериментов. Работы, которую на самом дели вели не одни только лауреаты (хотя каждый из них внес вполне измеримый вклад, а еще часто они работали вместе), а большие лаборатории, их сотрудники и коллеги. Нобелевскую премию по одной теме могут получить не больше трех человек. Но это некая условность, ведь современная наука, тем более в области биологии, никогда не делается в одиночку.
Понятно, что ни Джулиус, ни Патапутян не были первыми исследователями этой сложной, обширной, глубоко заходящей даже на философскую территорию темы. Вопросами о том, как человек в принципе может что-то чувствовать — тепло или холод, боль или ощущение положения тела, — занимались ученые чуть ли не со времен Гиппократа. Рене Декарт, которого Нобелевский комитет решил отметить в пресс-релизе отдельно, например, предложил в свое время довольно остроумную (и не такую уж, в общем, ошибочную) теорию о том, что жар, касаясь кожи, дергает за ниточки, ведущие в мозг.
Чтобы понять, что поменяли в этой большой науке конкретно Джулиус и Патапутян, представьте себе инопланетян, наблюдающих за масштабной битвой, вроде Бородино, и изучающих, как земляне ведут войну. Они уже очень подробно выяснили, как в целом выглядит театр боевых действий. Они исследовали и нанесли на карту место, где находится батарея Раевского, начертили Багратионовы флеши, научились отличать русских и французов друг от друга, а в каждой армии — рядового от генерала.
Но одну, мягко говоря, немаловажную вещь инопланетяне так и не поняли: почему некоторые из бойцов то и дело вдруг падают на землю — и перестают участвовать в дальнейших событиях?
Следуя этой метафоре, можно сказать, что Джулиус и Патапутян объяснили устройство ружья и пули — то есть придали всей замысловатой, абстрактной, высокоуровневой науке о сенсорных ощущениях конкретный физический смысл. Описали движение конкретных атомов внутри конкретных молекул, за работу которых отвечают конкретные гены.
Да, по состоянию на 2021 год наши метафорические инопланетяне до сих пор не понимают, почему иногда ружья дают осечки, не могут их как следует чинить и даже не догадываются о том, что думает о происходящем главнокомандующий. Тем не менее теперь картина происходящего стала понятнее в каком-то принципиально новом смысле — и именно в этом понимании и есть заслуга нынешних лауреатов.
Что именно они открыли?
Переходя от метафор к конкретным экспериментам лауреатов, можно ограничиться всего двумя: один проведен группой Джилиуса и опубликован в авторитетном научном журнале Nature в 1997 году, другой сделан группой Патапутяна на 13 лет позже и вышел в журнале-конкуренте, Science. Эти два ключевых эксперимента и есть конкретно то, за что нынешние лауреаты получили награду.
К концу 1990-х ученым уже много десятилетий было хорошо известно, что у «рецептора жары и холода» должен быть своеобразный «бэкдор»: помимо, собственно, высокой температуры, такие нейроны легко активировались одним довольно простым веществом, имитирующим боль, — капсаицином. Это жирорастворимое соединение содержится в остром перце, и именно его концентрация определяет то, насколько перец окажется жгучим. Также было известно, какие именно нейроны реагируют на капсаицин, и было понятно, что воздействие высокой температуры и боль на уровне нейронов — это одно и то же. Просто если боль, например, локализована на языке и сопровождается поеданием халапеньо, мы воспринимаем ее как своеобразный вкус, а не как ожог. Но, вообще-то, разница очень поверхностная.
Однако перед Джулиусом стояла проблема: даже если известны нейроны и есть вещество, которым можно их специфически активировать, для того, чтобы по-настоящему понять механизм чувствительности, нужно было найти молекулярную мишень этого вещества. Нужно было научиться воспроизводить процесс активации в совершенно других клетках, придав им болевую чувствительность — тогда можно было бы утверждать, что все компоненты этой системы известны. У Джулиуса в некотором смысле был дом с тысячами замков, один из которых точно можно было открыть имеющимся ключом. И хотя этот ключ находился у него в руках, было совершенно неясно, куда именно его нужно вставлять — а без этого знания понять устройство замка было совершенно невозможно.
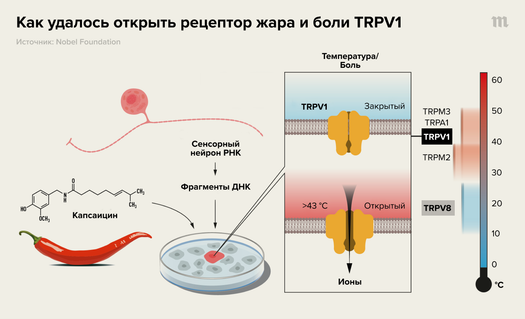
Решить этот ребус удалось с помощью огромного везения и следующего эксперимента. Ученые предположили, что за чувствительность нейронов к теплу и боли (и, конечно, капсаицину) отвечает всего один самостоятельный белок-рецептор, способный открывать поток ионов в клетку и приводить к электрическому импульсу (именно тут им повезло — вообще говоря, этих белков могло быть очень много). Если это так, то ген этого рецептора, будучи перенесенным в совершенно новую клетку, должен дать ей ту же самую чувствительность, что и у болевых нейронов, и клетки, которые раньше были, например, просто клетками эпителия почек, должны были начать реагировать на тепло и капсаицин.
Тогда ученые во главе с Давидом Джулиусом выделили из известных чувствительных к капсаицину нейронов всю имеющуюся РНК, получив таким образом «библиотеку» всех работающих в этих клетках генов. Они не стали брать все гены, содержащиеся в геноме человека вообще (перебор такого масштаба был бы очень сложным и потенциально безрезультатным), а использовали только те гены, что существовали в нейронах в форме РНК. То есть такие, что действительно работали, а не «спали». Затем гены из этой библиотеки вставляли индивидуально в растущие на чашках клетки, добавляли специальное вещество-маркер, светящееся при высокой концентрации ионов кальция, и воздействовали на клетки капсаицином. Из тех образцов, что под действием капсаицина начинали неожиданно светиться, затем выделяли ДНК, в которой и находился ген термочувствительности. Он получил название TRPV1: TRP — это структурное семейство рецепторов (открытие которого у дрозофил, сделанное раньше, Нобелевский комитет на этот раз почему-то не отметил), а V1 или VR1 — это название рецептора.
Затем, уже зная природу первого чувствительного к температуре гена, TRPV1, ученые открыли множество его «родственников» («гомологов»), которые, как оказалось, обеспечивают тонкую чувствительность к температуре за счет небольших внутренних структурных отличий. Рецептор того же семейства, TRPM8, как оказалось, реагирует не на жару и не на боль, как TRPV1, а на холод. При этом, как ни странно он же очень важен для ощущения нормального тепла — оно возникает только тогда, когда TRPV1 и его «коллеги» TRPA1 и TRPM2 работают, а TRPM8 (в норме постоянно работающий) временно отключается.
Другой ключевой эксперимент — приведший к открытию механизма механочувствительности (к прикосновению, растяжению и др.) — был сделан группой второго лауреата, Ардема Патапутяна. Так же, как и в первом случае, ученым пришлось наблюдать за реакцией клеток на воздействие, обращая внимание на гены, которые при этом для этой реакции нужны. Только вместо переноса генов из нейронов в другие клетки группа Патапутяна скрупулезно выключала по одному самые разные гены-кандидаты в культуре нейробластов (незрелых нейронов), наблюдая при этом за их реакцией (или ее отсутствием). Удобного аналога капсаицина для исследования механочувствительности не нашлось, и ученым для наблюдения реакции пришлось в самом буквально смысле тыкать в нейроны «палочкой» и наблюдать при этом их реакцию.
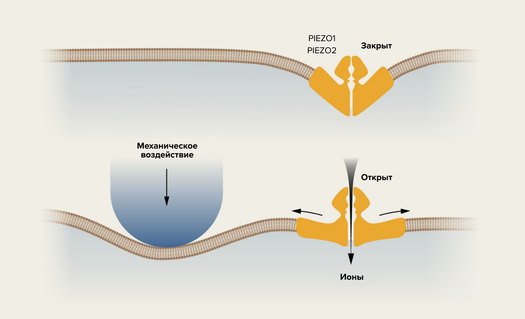
Именно таким образом удалось обнаружить ген, отключение которого полностью лишает клетки реакции на прикосновение. Точнее даже, это не один, а целое семейство генов, первыми и главными из которых стали PIEZO1 и PIEZO2. Из дальнейших экспериментов, в которых удалось установить трехмерную структуру этих рецепторов, стало понятно, как они работают: при нажатии клеточная мембрана растягивается, а вместе с ней растягивается и начинает пропускать ионы рецептор. Попадание же ионов в нервную клетку, конечно, ведет к его активации и формированию нервного импульса. Неизвестных подробностей о работе PIEZO1 и PIEZO2, конечно, осталось еще много, но эта механическая часть стала гораздо понятнее.
Зачем все это?
Илья Кельмансон
Институт биоорганической химии РАН, Российский национальный исследовательский медицинский университет имени им. Пирогова
TRP — довольно большое семейство [рецепторов], там довольно много разных каналов, они есть всюду, и то, как они участвуют в развитии заболеваний, — это очень большая тема, которая сейчас очень активно изучается. Эти рецепторы принимают участие в огромном количестве физиологических процессов, и понятно, что для «фармы» их исследование очень важно. Это касается прежде всего механизмов боли, мигрени. Вообще, лечение мигрени — это как раз одна из самых горячих точек в исследовании этих рецепторов.
Мы же в нашей лаборатории пытаемся применять эти рецепторы в качестве «актуаторов» — аналогично тому, как в оптогенетике для управления нейронами светом применяются светочувствительные ионные каналы, каналородопсины. Это ионные каналы, которые открываются в ответ на свет и пропускают ионы натрия. Аналогичным образом можно использовать и теплочувствительные каналы типа TRPV1 — для того, чтобы, например, подействовать на клетку инфракрасным излучением, теплом, попытаться ее тоже «включить» или «выключить». Это можно пытаться делать в тех случаях, когда по какой-то причине оптогенетические инструменты хуже подходят. Например, инфракрасное излучение существенно глубже проникает [в нервную ткань], чем видимый свет, соответственно, можно [с помощью каналов TRP] пытаться воздействовать на более глубокие клетки. Кроме того, TRP на три порядка лучше, чем каналородопсины, пропускают кальций, и с их помощью можно воздействовать на какие-то кальциевые процессы внутри клетки, воздействуя на них теплом.
Сергей Козлов
Лаборатория нейрорецепторов и нейрорегуляторов Института биоорганической химии РАН
Помимо того, что [семейство TRP] — это термочувствительные рецепторы, они еще и основные рецепторы ноцицепции, то есть проведения боли. И это будет поважнее, чем [сама по себе] термочувствительность. [Ингибиторы этих рецепторов] — это альтернатива опиоидным анальгетикам. Именно над этой проблемой мы активно работаем уже 12 лет.
Задача заключается в селективном ингибировании этих каналов, но не для того, чтобы влиять на термочувствительность — это неинтересно, — а для того, чтобы сделать новые обезболивающие. Работ в этой области ведется много, от больших и маленьких фармкомпаний, от ученых и университетов разных стран, но пока на рынок ничего не вышло. В том числе и мы [некоторое время назад] тоже предложили в качестве потенциальных ингибиторов свои пептиды, и даже провели их доклинические исследования — но нам в какой-то момент просто денег не хватило [чтобы двигаться дальше].
Александр Ершов
(1) Речь о «проблеме квалиа»
Философское, не естественнонаучное понятие, которое обычно определяют как субъективную сторону ощущения. То, какими именно боль, жар или холод кажутся тому, кто их ощущает. Для иллюстрации проблемы часто используют мысленный эксперимент нейрофизиолога Мэри, которая «знает все, что можно знать о зрении с точки зрения науки», но сама не может видеть. В тот момент, когда Мэри излечится от слепоты, узнает ли она что-то новое о зрении — или нет.
(2) При чем тут кальций?
Обычно кальция мало внутри клетки и много снаружи. Когда кальция в клетке становится много — это значит, что рецептор активировался и открылся.
(3) Откуда буква V?
От слова «ваниль»: рецептор реагирует, помимо капсаицина, на многие похожие вещества с таким же структурным ядром ванилина.
(4) Насколько она тонкая?
Набор нескольких похожих, но активируемых при разной температуре генов позволяет человеку и вообще млекопитающим ощущать разницу температур на коже в 0,5 градуса Цельсия.
(5) Оптогенетика
Технология исследований мозга, основанная на использовании светочувствительных рецепторов (опсинов) для управляемой активации отдельных нервных клеток. Обычно это делается так: нейроны мозга животного заражают вирусом, несущим ген опсина, а в мозг ему подводят оптическое волокно. Посылая свет по оптоволокну, можно включать только те нейроны, которые несут ген опсинов, а значит, находятся в нужном месте мозга или имеют определенную специализацию.
(6) Селективное ингибирование
То есть избирательное подавление, «выключение» таких каналов.