
За наши и ваши смартфоны. Нобелевскую премию по химии получили изобретатели литий-ионных аккумуляторов
Мы рассказываем честно не только про войну. Скачайте приложение.
Нобелевскую премию по химии в 2019 году присудили Джону Гуденафу, Стэнли Уиттенгему и Акире Ёсино. Это те самые люди, которых прежде всего следует благодарить за сегодняшний бум электромобилей, электросамокатов, портативных колонок, смартфонов, ноутбуков и всей остальной портативной техники. Практическая польза их работы очевидна, останавливаться на ней нет смысла, поэтому попробуем разобраться с тем, что именно и как нынешним лауреатам удалось сделать.
Можно ли объяснить простыми словами, как работает обычная литий-ионная батарейка?
Сделать это гораздо проще, чем ее изобрести. Но для начала надо уточнить, что премию присудили именно за создание аккумулятора, а не изобретение «батарейки» — аккумуляторами называют не любые источники тока, а только такие, которые можно многократно перезаряжать.
Все аккумуляторы работают за счет того, что в них происходят химические реакции с обменом электронами между атомами. Такой же обмен происходит, например, при горении: углерод отдает свои электроны более «жадному» до них кислороду, при этом выделяется энергия в виде тепла.
Отличие аккумуляторов в том, что в них этот обмен электронами идет не напрямую от атома к атому, а очень кружным путем: через провода, микросхемы, диоды и обмотки моторов. Электроны, вышедшие из отрицательного электрода, в конце концов возвращаются в положительный, но энергия, которая при горении ушла бы в тепло или свет, в аккумуляторах превращается в электричество.
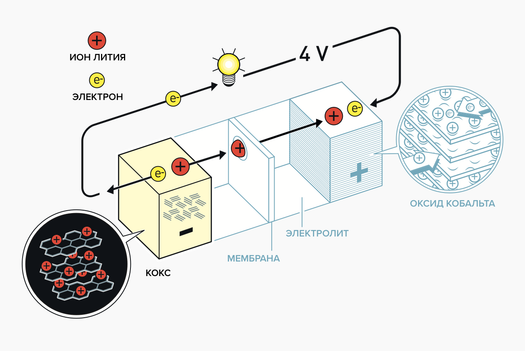
Конкретно в литиевых аккумуляторах реакция идет между ионом лития и веществами, из которых составлены электроды. В самом литии как элементе ничего особенного нет, его мог бы заменить и другой металл. Сложность, с которой справились нынешние лауреаты, заключалась не столько в том, чтобы выбрать правильный металл, сколько в том, чтобы подобрать для него правильные электроды и собрать все это в работающую систему.
В заряженном состоянии ионы лития в аккумуляторе сидят в удобных для них шестиугольных ячейках, образованных углеродными атомами в коксе (у ранних аккумуляторов) или в графите (у современных). Когда к устройству подключают нагрузку, атомы лития покидают свои посадочные места, оставляя в них свои электроны. После этого они и устремляются к противоположному электроду, где для лишенных электронов ионов находятся еще более удобные (в химическом смысле) посадочные места. А оставленные в графите электроны устремляются в электрическую цепь, производят работу и в конце концов возвращаются в аккумулятор, только уже на противоположном его конце. Когда устройство ставят на зарядку, все повторяется с точностью до наоборот.
Каков вклад в изобретение аккумуляторов каждого из нынешних лауреатов?
Начало работы над современными литий-ионными батареями можно условно отсчитывать от прихода Стэнли Уиттенгема в компанию Exxon в 1972 году. Тогда на фоне нефтяного кризиса энергетический гигант заинтересовался возможностью диверсификации своих активов и поэтому решил вложить некоторое количество ресурсов в исследование химии аккумуляторов.
Работая в Exxon, Уиттингему почти случайно удалось обнаружить эффект интеркаляции, без которого современных литий-ионных батарей бы не было — хотя литий в тех экспериментах еще не использовался. Ученый обнаружил, что некоторые вещества способны впитывать в себя ионы металлов как губка и при этом не разрушаться и сохранять свою структуру. Это означало, что в их кристаллической решетке есть достаточное количество удобных посадочных мест для ионов. А значит, из них могут получится превосходные кандидаты в электроды для аккумуляторов.
Первоначально Уиттингем работал с очень тяжелым веществом — сульфидом тантала, из которого бы не получилось хорошего конкурента для старинных свинцово-кислотных аккумуляторов. Тантал быстро заменили на более легкий титан, но электрический потенциал, который возникал при этом на электроде, все равно был не слишком большим. Он определяет емкость аккумуляторов — чем электрический потенциал выше, тем больше энергии в себе может накопить устройство. Сам же потенциал зависит от химического «удобства» посадочных мест для ионов, которые используются в устройстве.
Вклад Джона Гуденафа изменил именно это — благодаря тому, что он догадался заменить сульфид на оксид, а титан на кобальт, ему удалось значительно увеличить удобство посадки ионов на электрод и таким образом добиться двукратного увеличения электрического потенциала и емкости аккумулятора.
К середине 1980-х оставалась проблема со вторым электродом — тем, где литий должен был накапливаться во время заряда аккумулятора. До этого химики пытались использовать в качестве отрицательного электрода сам металл, но очень часто это приводило к пожарам и коротким замыканиям — они возникали тогда, когда ток шел не через полезную нагрузку, а напрямую — через образовавшиеся в аккумуляторе кристаллы лития.
Эту проблему в 1986 году удалось решить Акире Ёсино. Используя в качестве отрицательного электрода обычный нефтяной кокс (а затем и графит), он обнаружил, что в этом материале ионы металла не образуют кристаллы, а осаждаются в ячейках, образованных атомами углерода. Благодаря этому углеродные электроды способны накапливать литий в очень большой концентрации и при этом не допускать образования чистого металлического лития, который довольно опасен.
Уже в 1991 году на основе разработок Ёсино и его коллег удалось создать первую коммерческую литий-ионную «батарейку», что означало начало эпохи по-настоящему портативной техники.
Что говорят о сегодняшних лауреатах российские химики?
Артем Абакумов, профессор Сколтеха, директор центра Энергетических наук и технологий
Основное достоинство литий-ионных аккумуляторов — это высокая плотность энергии на единицу массы и на единицу объема. Поэтому они нашли естественное применение в мобильных телефонах, ноутбуках и других портативных устройствах. Фактически индустрии смартфонов не было бы, если бы не было литий-ионных аккумуляторов. То количество энергии, которое потребляет процессор современного телефона, нельзя было бы обеспечить каким-либо другим источником энергии.
Дмитрий Семененко, заведующий лабораторией накопителей энергии Института арктических технологий МФТИ
К тому моменту, когда были опубликованы основные работы нынешних лауреатов, идея использовать литий в химических источниках была не нова. Уже существовали подобные устройства — не аккумуляторы, а именно источники, которые можно было перезарядить всего один-два раза. Заслуга Ёсино и его коллег заключается в том, что им удалось создать электрод, на котором при зарядке не возникало металлического лития и поэтому не было риска короткого замыкания. Таким образом удалось получить источник, в котором при той же массе было в шесть раз больше энергии, чем в свинцовом аккумуляторе, сделанном по технологии XIX века.
Уже после этого произошло другое важное открытие — создание литий-железного (точнее литий-железо-фосфатного) аккумулятора. Он не стал каким-то рекордсменом по плотности энергии, но важнее было, что при примерно тех же параметрах он оказался значительно дешевле. Ключевую роль в его изобретении сыграл Джон Гуденаф, который предсказал существование вещества, которое могло бы стать положительным электродом в таком устройстве. Больше половины электротранспорта, который сейчас существует, работает именно на таких аккумуляторах. И именно этому изобретению мы обязаны тем бумом электромобилей, который сейчас наблюдаем.
Что касается Уиттенгема, то надо не забывать, что его вклад заключается еще и в том, что он догадался использовать в качестве положительного электрода не просто классический оксид кобальта, но его замещенную форму, где вместо кобальта есть марганец и никель. Именно такие многокомпонентные смешанные оксиды используются сейчас в аккумуляторах телефонов и ноутбуков.
Александр Ершов, Павел Мерзликин
(1) Реакции с обменом электронами
Они же окислительно-восстановительные реакции. Почти все химические реации относятся к этому обширному классу. Но все-таки не все: например, реакции с атомами радикалами, благодаря которым получают некоторые пластики из мономеров, к нему не относятся.
(2) Как, совсем ничего?
Космологи бы сказали, что литий — это очень особенный элемент. Он единственный из всех металлов возник прямо в момент Большого взрыва. Да еще и почему-то в необъяснимо малом количестве.