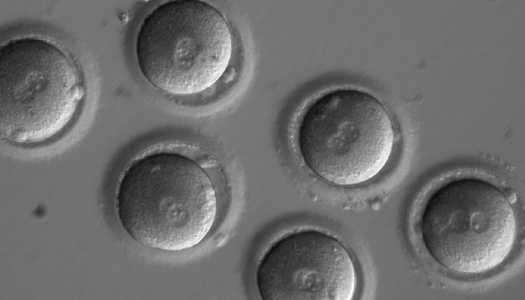
Ученые отредактировали геном эмбриона — и избавили его от генетического заболевания. Скоро наследственные болезни уйдут в прошлое?
Мы рассказываем честно не только про войну. Скачайте приложение.
2 августа издание Nature опубликовало статью группы южнокорейских и американских ученых: под руководством Шухрата Миталипова им удалось избавить эмбрион человека от дефектного гена, приводящего к развитию тяжелого заболевания — гипертрофической кардиомиопатии. Это не первая попытка редактировать человеческие эмбрионы. В июне 2017 года появились результаты схожей работы китайских ученых, однако ее нельзя было назвать особенно успешной. Обе группы исследователей использовали технологию CRISPR-Cas9, которая позволяет найти в ДНК нужный ген и удалить или подправить его. «Медуза» попросила доктора биологических наук профессора Сколковского института науки и технологий и университета Ратгерса в США Константина Северинова объяснить, как действовали исследователи и что означает их успех для будущего медицины.
Что сделали ученые?
Они успешно отредактировали геном человеческих эмбрионов в лабораторных условиях. В клетках нашего тела содержатся по две копии большинства генов. У людей с гипертрофической кардиомиопатией одна копия гена под названием MUBPC3 нормальная, а другая — с мутацией. В половых клетках (сперматозоидах или яйцеклетках) остается только одна копия каждого гена. В исследовании ученые использовали сперму мужчины с гипертрофической кардиомиопатией, и в ней, соответственно, половина сперматазоидов была нормальная, а половина — с мутацией. В результате 50 процентов эмбрионов, полученных с помощью этой спермы, имели мутантный ген, а другие 50 процентов — нет. Таким же был бы процент здоровых детей и детей с гипертрофической кардиомиопатией, рожденных от этого мужчины. После редактирования зигот (оплодотворенных яйцеклеток) здоровых эмбрионов стало не 50 процентов, а 72 процента. Другими словами, почти половину зигот с мутацией удалось отредактировать. Если бы пара, в которой один или оба партнера имеют гипертрофическую кардиомиопатию, решила родить ребенка без этой болезни, редактирование сильно бы повысило их шансы. Процедура бы состояла в обычном экстракорпоральном оплодотворении, но с дополнительной стадией редактирования, чтобы увеличить число эмбрионов без мутации.
Это прорыв?
Да. В более ранних работах китайские ученые использовали CRISPR-Cas9, чтобы справиться с генетическими болезнями крови. В целом их эксперименты нельзя было назвать вполне удачными. Одна из причин, по-видимому, была в том, что редактор доставлялся в яйцеклетки не вместе со сперматозоидом, а позже — когда ДНК сперматозоида была уже внутри — и началось копирование родительских генов. В только что оплодотворенной яйцеклетке каждый ген представлен одной материнской и одной отцовской копией. Через некоторое время копий ДНК становится больше — последовательно в два, четыре раза и так далее. Чем больше копий мутантного гена, тем хуже идет редактирование.
Когда число генов удваивается, яйцеклетка делится. Если во время первого деления одна копия отцовского гена оказалась отредактирована, а другая — нет, то эмбрион, а, в конечном счете, и взрослый организм будут мозаичными: половина клеток будет иметь мутантную копию отцовского гена, а половина — отредактированную.
Авторы новой работы показали, что, если вводить в яйцеклетку редактор Cas9 одновременно со сперматозоидом, мозаичность существенно снижается, то есть «исправленный» вариант гена присутствует почти во всех клетках эмбриона.
Что можно лечить с помощью этой технологии?
Описано большое количество моногенных генетических заболеваний. Все оно довольно редкие и возникают из-за мутации («поломки») в каком-то одном гене. Это, например, муковисцидоз, серповидно-клеточная анемия, гемофилия и талассемии. С помощью технологии эмбрионального геномного редактирования теоретически мы можем предотвратить появление людей с такими заболеваниями. Но есть масса заболеваний, вызванных мутациями в множественных генах. Теоретически для вылечивания таких заболеваний с помощью CRISPR-Cas9 нужно просто ввести в клетки редактор, который запрограммирован узнавать не одно место в ДНК, а несколько. Такое мультиплексное редактирование можно осуществить на практике. Но проблема в том, что для подавляющего большинства этих полигенных заболеваний точные комбинации генов/мутаций, ответственных за заболевание, не известны. Например, мы знаем, что у шизофрении есть генетическая подоплека, но полный набор генов, ответственных за шизофрению, неизвестен. С другой стороны, есть болезни, генетическая природа которых известна очень хорошо, например, синдром Дауна, вызванный наличием лишней хромосомы, но лечить такое состояние с помощью CRISPR-Cas9 невозможно даже теоретически.
Чем потенциально опасен этот метод, если его станут применять в медицине?
Ничем особенно не опасен, если соблюдать необходимые предосторожности. В более ранних опытах редактор оказывался недостаточно точным: кроме изменения в нужном месте ДНК во многих эмбрионах обнаруживались нежелательные мутации. Они возникали из-за того, что редактор делал свою работу в неправильных, незапрограммированных местах.
Эта работа показывает, что можно подобрать условия, когда редактирование проходит точно: последовательности ДНК, которые ученые не хотят изменять, остаются не измененными. А значит, если бы из отредактированных эмбрионов вырос человек, то он ничем не отличался бы от не отредактированного, с той лишь разницей, что у него или у нее не было бы кардиомиопатии, которая гарантированно появилась бы без редактирования.
Далеко ли до «дизайнерских детей»?
Сейчас мы более-менее понимаем простые генетические болезни. Все остальные видимые глазом свойства нашего тела (рост, вес, толщина ногтей), а тем более интеллект или спортивные способности определяются сложной комбинацией очень многих генов. Каких именно — мы не знаем. Кроме того, на развитие таких свойств очень сильно влияет среда, воспитание, образование и другие факторы. Допустим, я хочу высокого ребенка, а сам — коротышка. Безусловно, есть гены, которые ассоциированы с ростом, можно даже что-то пытаться редактировать и подкручивать. Но если этого ребенка не будут нормально кормить, то он все равно вырастет маленьким.
Что дальше?
Дальше требуется проводить исследования на безопасность, и это долгая история. Конечная цель — вылеченные дети. Сейчас такие опыты запрещены. Но на мой взгляд, прогресс в этой области не остановить, это просто вопрос времени. Первые практические применения технологии редактирования будут в сельском хозяйстве: для инжиниринга сельскохозяйственных животных и растений с улучшенными товарными свойствами. Формально, такие животные могут быть отнесены к ГМО.
В России такие опыты будут проводиться?
Прорывных работ в этой области из российских лабораторий ожидать не стоит. В России подобные работы ограничены недавно принятым ретроградным законом о ГМО. Кроме того, они крайне затруднены неразвитой инфраструктурой и общим очень значительным отставанием в сфере современных наук о жизни. Так что остается радоваться успехам команд, работающих под руководством наших бывших соотечественников (Шухрат Миталипов из Орегонского университета — выходец из Казахстана — прим. «Медузы»).
Константин Северинов
(1) Экстракорпоральное оплодотворение
Процедура, при которой в матку женщины подсаживают эмбрион, полученный в результате оплодотворения яйцеклетки сперматозоидом в лаборатории